近些年來,許多研究表明,一些不會翻譯成蛋白質的非編碼RNA同樣在多種細胞活動中不可或缺。是以,了解RNA的功能和代謝就變得至關重要,而隻有我們明确了RNA的生理功能,才可能在異常疾病狀态下對其進行調控和糾正。
然而,RNA具有動态多變的特點,它的分布也具有時間和空間的特異性,這也為研究RNA提出了更高的要求,需要找到一種技術可以對RNA進行精準地調控,進而了解其在細胞當中的功能。
近日,華東理工大學楊弋教授團隊研發出一種光控的RNA結合蛋白,這種蛋白會與RNA上特定序列結合,就像是安上了光敏開關,通過對光的調節就可以實作對RNA功能和代謝的改變。這項研究結果發表于《自然·生物技術》(Nature Biotechnology)上。本文第一作者陳顯軍告訴果殼:“我們的團隊一直聚焦光遺傳學技術的發展與應用,未來除了繼續在這個領域深耕,我們也希望盡快推進技術的産業化。”
如何實作用光調控蛋白與RNA的結合?
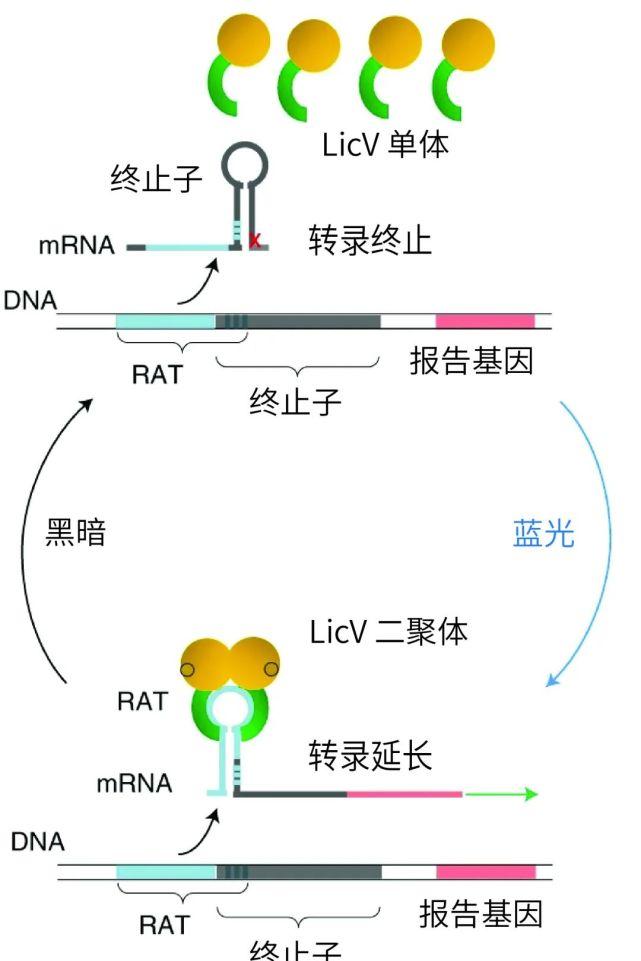
LicV單體可在藍光照射下形成二聚體,并與RNA結合 | 自然·生物技術[1],果殼作者漢化
這種全新的光控RNA結合蛋白由兩個核心子產品組成:其一是從枯草杆菌中發現的轉錄抗終止蛋白的RNA結合結構域LicTCAT,在兩個LiCTCAT發生二聚化時,就可以特異性地與核糖核抗終止RNA(RAT)序列結合,進而阻止RNA終止莖-環結構的形成;其二則是可以在藍光的激活下迅速發生二聚化的Vivid蛋白(VVD)。
這兩個核心子產品賦予了LicTCAT-VVD融合蛋白可以在光的誘導下發生二聚化,進而增強其與RNA結合的能力,去掉光源則會出現蛋白二聚體及RNA與蛋白質的逐漸解離。研究者們以紅色熒光蛋白作為報告基因,對LicTCAT和VVD之間含有不同連接配接子的融合蛋白進行測試,找到了藍光照射和黑暗狀态下具有最大熒光強度變化的融合蛋白,并把它命名為LicV。
不同應用場景下的效果如何?
将不同效應蛋白與LicV結合獲得的融合蛋白可在光控下影響RNA的代謝|自然·生物技術[1],果殼作者漢化
既然藍光可以調控LicV蛋白與含有RAT的RNA序列結合,那麼這個系統是否可以對RNA的功能和代謝産生影響呢?研究者們将一系列具有不同功能的效應蛋白結構域與LicV融合在一起,測試藍光能否讓這些效應蛋白發揮相應的作用。
細胞内定位是RNA發揮正常功能的基礎。研究者們嘗試将LicV與多種不同的亞細胞内定位的信号融合,在藍光照射時含有RAT序列的RNA及其報告蛋白可在較短時間内出現與定位信号一緻的亞細胞定位。而當恢複黑暗時,這種特異性的位置改變又會逐漸消失。
DNA轉錄後去除内含子、合并外顯子的剪接過程是形成編碼RNA的重要步驟。将LicV分别與促進或阻礙外顯子保留的剪接蛋白融合便形成了光控的剪接因子,給予光照後,即可使剪接報告RNA出現不同的剪接方式。
RNA翻譯是生物産生蛋白質的基本方式。将LicV與翻譯起始因子4E融合,藍光照射下,報告蛋白的翻譯顯著增強,翻譯的強度還會受到光照強度的影響。
RNA完成功能後會發生降解。研究者們将LicV與一個小型RNA剪切子產品barnase融合,在藍光下與目标RNA的RAT莖-環結合,令其具有很強的剪切活性,但黑暗下,非特異的剪切活性可忽略不計。
通過多種場景的嘗試,科研團隊發現LicV是一種可用範圍廣泛的光控RNA結合蛋白,通過将其與不同的效應蛋白的融合,就可達到在時間和空間上對RNA進行調控。陳顯軍告訴果殼,由于在一定範圍内效應因子作用與光強呈正相關,并且VVD對藍光區域的光最敏感,通過調節光強和波長,甚至可以達到對RNA的定量調節。
強強聯合
CRISPR技術在生命科學領域迅猛發展 | 圖檔HHMI.org
近些年,CRISPR/Cas9系統的發展為生命科學研究帶來了颠覆性的改變,它廣泛地應用于基因組編輯、高通量的基因組功能篩選、活細胞成像等領域。Cas9蛋白在向導RNA的引導下對基因組内的目标位置進行精準定位。
那麼LicV是否可以與CRISPR聯合使用呢?
研究者們将RAT序列巧妙地與向導RNA結合,再将LicV蛋白與轉錄激活結構域VPR結合,研發出LA-CRISPR聯合系統。在藍光的照射下,被向導RNA定位的靶點基因的表達就會顯著升高,既發揮了CRISPR系統的準确定位優勢,又可以達到光控的效果。研究者們還将綠色熒光蛋白與LicV結合,通過LA-CRISPR實作了光控下的基因組位點的熒光标記。
CRISPR技術存在一定程度的脫靶效應,即基因組當中一些非目标位置成為了CRISPR的作用靶點。那麼,LA-CRISPR系統是否存在相同的技術問題呢?果殼從陳顯軍處得知,研究人員正在開展相關研究,以降低CRISPR的脫靶效應,進而達到對RNA的精準調控。
應用前景
基于RNA的治療手段可能為戰勝疾病帶來新的契機 | Science.org
這種光控RNA結合蛋白LicV的研發在一定程度上為研究RNA的功能打開了一扇嶄新的大門。當下的研究中,對于RNA誘導性表達的調控往往通過藥物進行,藥物不僅對細胞存在潛在毒性,這種實驗還僅能獲得有關RNA表達單一調控方式的資訊。
陳顯軍還告訴果殼:“LicV是基于合成生物學設計理念建構,分别來自枯草杆菌(Bacillus subtilis)和粗糙脈孢菌(Neurospora crassa),它們與哺乳動物細胞組分是生物正交的,是以具有很好的生物安全性。”同時,LicV與不同的效應分子結合就可以對RNA定位、剪接、翻譯、降解等多個過程進行精準改變。
此外,LicV系統的研發更是一種研發模式的開啟,這種蛋白受到藍光調節,或許未來研究者們還能找到對其他光譜範圍敏感的受體蛋白。試想如果将不同顔色的光控蛋白轉入細胞内,就可以實作通過不同的光照,同時對多種RNA進行調控的目标,為研究多種複雜生命活動提供了有效工具,擴充了生命科學研究的工具箱,使從事這類研究的科學家可以更充分全面地了解RNA的功能。
“RNA是當下生物醫藥研究的前沿焦點,RNA除了參與細胞的幾乎所有重要生命過程,其本身還可作為藥物參與疾病的防治,如mRNA疫苗、幹擾RNA等。是以,發展能夠對這些RNA進行精密控制的方法将會極大促進RNA的功能解析以及基于RNA的生物醫藥領域的發展。”陳顯軍解釋道,“基于LicV的RNA光遺傳學技術可以讓人們精确控制RNA的轉錄、剪接、定位、翻譯、降解等代謝行為,相比較傳統的方法,該方法具有極佳的可控性,其時間分辨率可達毫秒,而空間分辨率可達亞細胞尺寸,這使得它可避免治療過當和治療不足,有望真正實作精準醫療。”
目前,研究者們正在開展将LicV應用到活體組織的實驗,并已獲得初步結果。盡管此項技術距離臨床應用還有一段距離,但未來值得期待。
緻謝
感謝華東理工大學楊弋課題組陳顯軍博士對本文的審閱和建議。
參考文獻
作者:郭怿暄
編輯:酥魚
排版:尹甯流
研究團隊
光遺傳學與合成生物學交叉學科研究團隊 | 陳顯軍供圖
通訊作者楊弋:博士畢業于清華大學生物化學,畢業後赴美哈佛大學醫學院進行金屬硫蛋白的博士後研究工作。現任華東理工大學藥學院及國家生物反應器工程重點實驗室特聘教授,從事合成生物學與光遺傳學前沿技術發展與應用研究。
通訊作者陳顯軍:博士畢業于華東理工大學藥學院化學生物技術與工程專業。2015年開始從事華東理工大學藥學博士後研究。華東理工大學生物反應器工程國家重點實驗室固定成員,研究方向為新型光遺傳學技術的開發與應用及生物大分子熒光标記技術開發與應用。