▎藥明康德内容團隊編輯
肝癌是全球癌症相關死亡的第三大原因,其中最常見的類型是肝細胞癌(HCC)。對于早期肝細胞癌而言,手術切除是标準治療。但多達70%患者在術後仍會複發,并且尚無圍手術期幹預顯示出生存益處。
近日,《柳葉刀-胃腸病學和肝髒病學》最新發表一項來自西奈山伊坎醫學院(Icahn School of Medicine at Mount Sinai)團隊的2期臨床試驗結果。研究顯示,新輔助免疫治療cemiplimab(PD-1抑制劑)在近1/3患者中誘導了惡性良性腫瘤細胞在術前大面積(≥50%)死亡。
論文指出,這是“迄今報道的肝細胞癌PD-1抑制劑單藥新輔助治療的最大臨床試驗。”研究中觀察到的病理緩解支援設計更大規模的試驗,來進一步确定最佳治療持續時間并明确臨床獲益。
截圖來源:The Lancet Gastroenterology & Hepatology
既往研究已經初步顯示,新輔助免疫治療在多種惡性良性腫瘤類型中能夠誘導病理緩解,并可能降低肝細胞癌術後複發風險。新輔助免疫療法不僅可以殺死惡性良性腫瘤,還有望通過持久的免疫反應,殺死手術難以完全消除的微小癌細胞,而這些微小癌細胞可能導緻未來的癌症複發或轉移。是以,這項研究旨在評估cemiplimab新輔助治療在可切除肝細胞癌患者中的臨床活性。
這是一項單臂、開放标簽的2期試驗,共納入了21例可切除肝細胞癌(Ib、II和IIIb期)患者,患者接受cemiplimab新輔助治療(350 mg靜脈輸注,每3周接受兩個周期治療),随後進行手術切除,術後再進行cemiplimab輔助治療(350 mg靜脈注射,每3周接受8個周期)。
研究主要終點是病理檢查的顯著惡性良性腫瘤壞死(tumour necrosis,定義為切除惡性良性腫瘤>70%壞死)。次要終點包括手術延遲、總體緩解率、CD8+ T細胞密度的變化和不良事件。在接受至少一劑cemiplimab并完成手術切除的所有患者中分析惡性良性腫瘤壞死和緩解率;在意向治療人群中分析安全性和其他終點。患者接受了治療前活檢,并在整個治療過程中接受了血液采集。
所有入組患者都接受了cemiplimab新輔助治療,20例患者成功切除。其中4例(20%)患者在新輔助免疫治療後觀察到明顯的惡性良性腫瘤壞死,包括3例(15%)為完全壞死;7例(35%)患者惡性良性腫瘤壞死率≥50%。根據影像學結果,3例(15%)患者達到部分緩解(惡性良性腫瘤體積縮小≥30%),所有其他患者的疾病保持穩定。
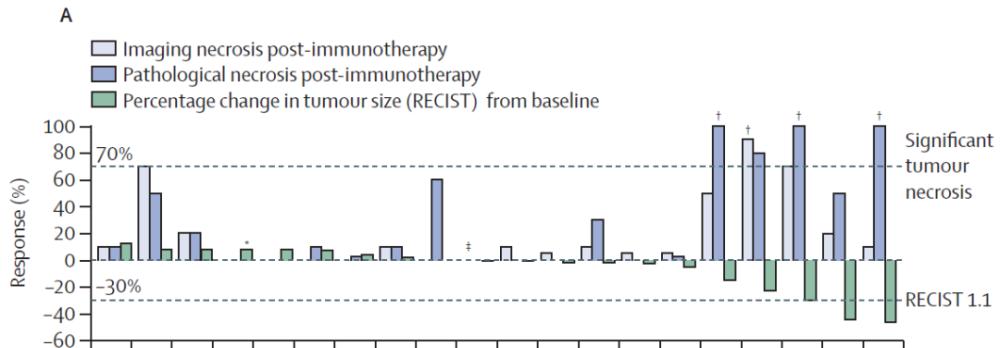
▲20例手術患者的緩解(影像學)和惡性良性腫瘤壞死(影像學和病理學)情況。(圖檔來源:參考資料[1])
惡性良性腫瘤壞死的MRI評估結果與病理學評估結果密切相關,但壞死評估結果(無論病理學或影像學)與惡性良性腫瘤緩解結果隻有中度相關性,并且這種相關性并不顯著。這種差異提示,每個名額在量化惡性良性腫瘤體積減少方面都有各自的局限性。
免疫組化分析顯示,壞死率≥50%的患者,往往在治療前的免疫細胞數量就更多,治療後免疫浸潤密度和惡性良性腫瘤浸潤淋巴細胞進一步增加,包括CD8+ T細胞浸潤顯著增加。換言之,治療前免疫系統已在對抗癌症的患者往往對免疫療法有更多的反應,且免疫系統會被免疫療法進一步激活。
治療安全性可接受。沒有一名患者因不良事件而取消手術。新輔助免疫療法的一大可預見潛在障礙是因毒性風險而導緻根治性手術延遲,這項試驗中,隻有1例患者出現肺炎,導緻手術延遲2周。
20名(95%)患者在新輔助治療期間出現任何級别的治療相關不良事件。最常見的任何級别不良事件是天冬氨酸氨基轉移酶升高(4例)、血肌酸磷酸激酶升高(3例)、便秘(3例)和疲勞(3例)。
7例患者出現3級不良事件,包括血肌酸磷酸激酶升高(2例)和低白蛋白血症(1例)。
未觀察到4級或5級事件。
圖檔來源:123RF
“我們認為患者在手術前接受免疫治療更好,因為人們在轉移前更健康,他們的免疫系統處于更好的狀态,可以更好抵抗癌症。結合許多其他類型惡性良性腫瘤的新輔助免疫治療試驗結果,這項研究支援了有必要評估圍手術期免疫治療政策以降低複發風險。”研究通訊作者、西奈山伊坎醫學院Thomas Marron教授表示,“未來更大規模的試驗将有助于确定新輔助免疫療法的實用性、安全性和生存獲益。”
同期評論文章也指出,未來研究應考慮肝癌新輔助免疫治療最合适的藥物組合、最佳治療持續時間以及基于危險因素分層的後續術後治療。早期疾病活動性名額(如惡性良性腫瘤壞死)與複發風險持久降低之間的相關性仍有待證明。