ChristianaCare 基因編輯研究所的科學家嘗試通過示範如何識别和評估基因調控和基因敲除對靶組織的影響,來提高 CRISPR 基因編輯技術在患者治療中的安全性和有效性。這項工作最近發表在《基因療法》上,成果主要展現在使用 CRISPR 系統對一個主要的調節基因做出調控,阻止它表達産生一種能夠降低患者化療效果的蛋白質。
網頁截圖
“我們發現,當使用 CRISPR 進行基因編輯時,有時它會更改而不是完全使目的基因沉默表達,是以我們開發了一個程式,以便更全面地了解這個機制對病人的影響,” ChristianaCare 基因編輯研究所的執行主任兼首席科學官、該研究的主要作者 Eric Kmiec博士解釋道。
Kmiec 博士針對他的團隊所從事的肺癌研究表示說,“我們研究發現,即使 CRISPR 遺傳操縱沒有使靶基因完全失去功能,它卻改變了靶基因的表達方式,進而使肺癌組織對化療更加敏感。
使用 CRISPR 驗證肺癌研究
“我們很幸運地發現,我們使用的 CRISPR 改善肺癌治療的政策再次得到驗證。” 他補充說。“但是,我們仍想要對我們的研究進行客觀的評估,這也是為了突出使用 CRISPR 敲除特定基因這一方法産生的所有潛在後果的重要性。具體來說,任何開發 CRISPR 療法的人都需要注意那些沒有完全敲除整段編碼DNA的編輯結果,并評估其對患者的潛在影響。這些結果可能就像我們的情況一樣是積極的,也可以是消極的或中性的,但它們需要被充分了解。”
很多關于 CRISPR 令人興奮的醫學應用都涉及到使用這種工具對一段特定的 DNA 序列或是有害基因進行敲除,緻使其失去原有功能。但是更多證據表明,通過CRISPR 編輯的細胞可能隻是改變了目标DNA序列的表達形式,這些靶基因仍可以繼續産生具有生物活性的蛋白質。
基因編輯 | clbiomed.com
該基因編輯研究所的科學家們正在研究使用 CRISPR 使一種名為 NRF2 的基因沉默的可能性,這個基因可以表達産生一種能夠阻礙鱗狀細胞癌組織免受化療或放療影響的蛋白質。在惡性良性腫瘤細胞實驗和動物研究中,已經證明了這些影響不會對正常細胞中有益健康的基因造成幹擾,并且對NRF2基因具有靶向選擇性。
為了在目前研究的基礎上更進一步。科學家們希望充分了解 CRISPR 基因編輯是如何使 NRF2 基因保留足夠的 DNA 編碼并繼續生産劣化版的蛋白質的。研究小組正在為一項将使用 CRISPR 技術來提高正常化療和放療的療效的臨床試驗奠定基礎。Kmiec 博士說,在試驗推進之前,他希望他的團隊開發一個明确的流程,用于識别和評估 CRISPR 編輯的所有結果。
識别和了解基因編輯過程中産物結果的多樣性一直是該基因編輯研究所建立以來的核心基礎研究項目。
安全地使用 CRISPR
Kmiec 博士表示:“我們以客觀無偏的方式進行實驗,把患者的安全和治療的有效性作為我們科學研究所努力的指導方向。” Kmiec 博士說,“無論我們發現或闡明什麼,它們都将幫助 ChristianaCare 研究是以及整個領域以更安全和更有效的方式去使用 CRISPR。”
研究人員在多個細胞中發現,NRF2基因中的目标DNA編碼鍊并沒有被完全破壞。相反,經過 CRISPR 編輯之後,一些保留了足夠的原始編碼,并可以繼續産生另一種形式蛋白質的細胞出現了。試驗表明,産生這些變異蛋白質的癌症惡性良性腫瘤細胞可能更容易受到化療藥物的攻擊。
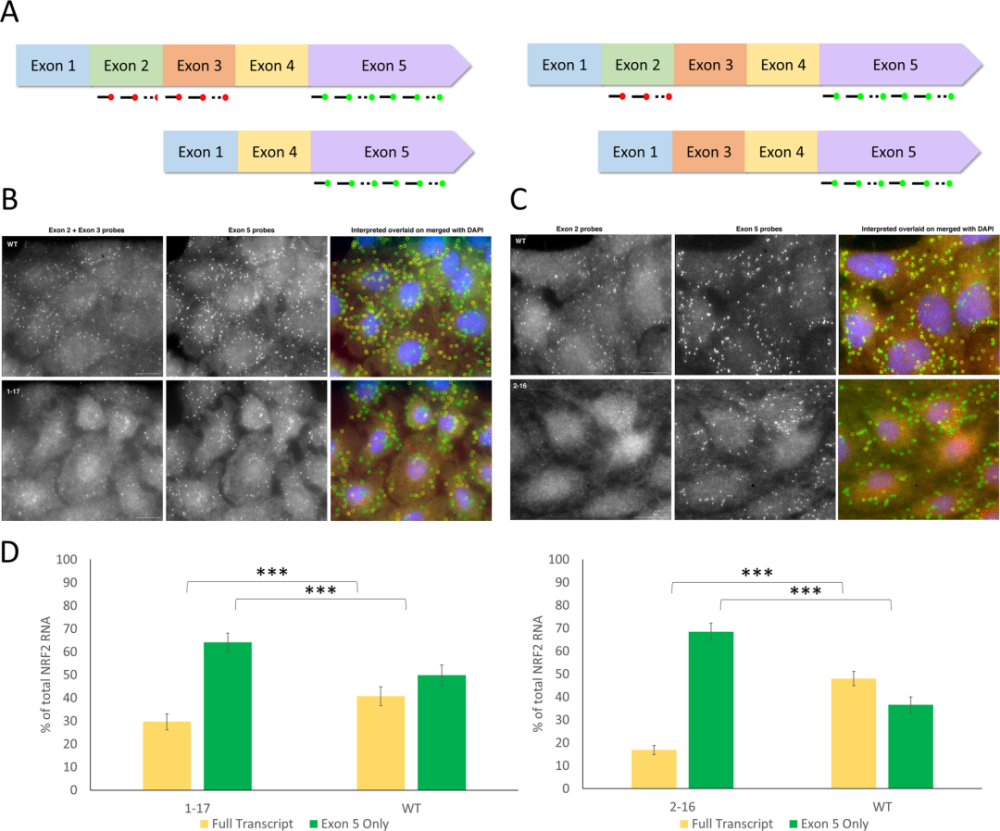
通過 smFISH 成像檢測改變的 NRF2 轉錄物 | 參考文獻[1]
文章第一作者 Kelly Banas 博士說:“對于我們圍繞 NRF2 所展開的工作,CRISPR 編輯後産生的删節版蛋白似乎使惡性良性腫瘤細胞對治療更加敏感。但關鍵是這些蛋白顯然具有生物活性,這意味着我們需要确定它們對使用 CRISPR 治療肺癌患者的安全性和有效性所産生的的潛在影響。”
Banas 博士指出,這項研究指出了原本僅僅通過确認原始目标蛋白質形式缺失就認為 CRISPR 編輯成功這一檢測标準的局限性。她說,如果按照這個标準,他們的基因編輯是成功的。經過編輯的 NRF2 基因不再産生原始形式的蛋白質。但是她又補充說,如果 ChristianaCare 研究小組所追求的目标就是這些,那麼他們就會忽略 NRF2 基因改變後産生的變異蛋白質,進而忽略一個重要的結果。在這種情況下,這個結果完善了最初的假設和實驗方法,即:使用 CRISPR 靶向編輯 NRF2 基因改善肺癌患者的治療結果。
盡職調查的重要性
Kmiec 博士說:“我們在這項研究中描述的過程應該作為一個在任何将 CRISPR 作為一種藥物治療的努力中都應該遵循的模闆。作為醫療保健機構的從業者,保證病人安全是我們的首要任務。我們同時也在令人興奮的尖端醫學領域發揮着先鋒作用,在這個領域,如果不執行嚴格盡職調查,那麼有可能會導緻使這個領域倒退數十年的悲劇性後果。通過這項研究,我們驗證了一個可以幫助這一領域快速而安全地向前發展的過程。”
CRISPR 代表“規律間隔成簇短回文重複序列”,它是一種在細菌中發現的防禦機制,可以識别并切除入侵病毒的病毒 DNA 序列。科學家們已經學會了如何修改這種機制,使其能夠被引導去“編輯”特定的 DNA 編碼序列。
參考文獻
[2] https://www.eurekalert.org/news-releases/946824
編譯:茵陳
編輯:酥魚
排版:尹甯流
題圖來源:站酷海洛
研究團隊
通訊作者Eric B. Kmiec:因其在分子醫學和基因編輯領域的開創性工作而聞名。自2014年以來,任基因編輯研究所所長。在他的職業生涯中,Kmiec博士一直上司着研究人類細胞中基因編輯的反應機制、生物化學和分子遺傳學的研究團隊。他早期在鐮狀細胞疾病方面的工作帶領了新一代基因編輯工具的研究和開發,包括 CRISPRs 和更有前景的變體,如用于治療遺傳性疾病的單鍊DNA寡核苷酸(ssODNs)。
第一作者Kelly Banas:研究員,她的研究興趣是開發和評估非小細胞肺癌的新型基因編輯政策。她目前的重點是用CRISPR基因編輯工具針對癌症特定的NRF2突變,并評估這些特定的靶向政策對受影響和鄰近細胞的短期和長期影響。凱利在惡性良性腫瘤細胞内發現了一個獨特的CRISPR靶點,而這個靶點在惡性良性腫瘤周圍的正常細胞中是不存在的,這為通過CRISPR指導的基因編輯來治療實體瘤建立了一個創新的基礎方法。她最近向美國食品和藥物管理局送出了她的主要研究結果,她的發現促成了一項臨床方案的制定。她于2021年畢業于特拉華大學,獲得分子醫學博士學位。
課題組網站
https://christianacare.org/people/eric-kmiec-phd/
如果想了解更多産業界和科技創投資訊,
歡迎關注果殼硬科技