ChristianaCare 基因编辑研究所的科学家尝试通过演示如何识别和评估基因调控和基因敲除对靶组织的影响,来提高 CRISPR 基因编辑技术在患者治疗中的安全性和有效性。这项工作最近发表在《基因疗法》上,成果主要体现在使用 CRISPR 系统对一个主要的调节基因做出调控,阻止它表达产生一种能够降低患者化疗效果的蛋白质。
网页截图
“我们发现,当使用 CRISPR 进行基因编辑时,有时它会更改而不是完全使目的基因沉默表达,因此我们开发了一个程序,以便更全面地了解这个机制对病人的影响,” ChristianaCare 基因编辑研究所的执行主任兼首席科学官、该研究的主要作者 Eric Kmiec博士解释道。
Kmiec 博士针对他的团队所从事的肺癌研究表示说,“我们研究发现,即使 CRISPR 遗传操纵没有使靶基因完全失去功能,它却改变了靶基因的表达方式,从而使肺癌组织对化疗更加敏感。
使用 CRISPR 验证肺癌研究
“我们很幸运地发现,我们使用的 CRISPR 改善肺癌治疗的策略再次得到验证。” 他补充说。“但是,我们仍想要对我们的研究进行客观的评估,这也是为了突出使用 CRISPR 敲除特定基因这一方法产生的所有潜在后果的重要性。具体来说,任何开发 CRISPR 疗法的人都需要注意那些没有完全敲除整段编码DNA的编辑结果,并评估其对患者的潜在影响。这些结果可能就像我们的情况一样是积极的,也可以是消极的或中性的,但它们需要被充分了解。”
很多关于 CRISPR 令人兴奋的医学应用都涉及到使用这种工具对一段特定的 DNA 序列或是有害基因进行敲除,致使其失去原有功能。但是更多证据表明,通过CRISPR 编辑的细胞可能只是改变了目标DNA序列的表达形式,这些靶基因仍可以继续产生具有生物活性的蛋白质。
基因编辑 | clbiomed.com
该基因编辑研究所的科学家们正在研究使用 CRISPR 使一种名为 NRF2 的基因沉默的可能性,这个基因可以表达产生一种能够阻碍鳞状细胞癌组织免受化疗或放疗影响的蛋白质。在肿瘤细胞实验和动物研究中,已经证明了这些影响不会对正常细胞中有益健康的基因造成干扰,并且对NRF2基因具有靶向选择性。
为了在目前研究的基础上更进一步。科学家们希望充分了解 CRISPR 基因编辑是如何使 NRF2 基因保留足够的 DNA 编码并继续生产劣化版的蛋白质的。研究小组正在为一项将使用 CRISPR 技术来提高常规化疗和放疗的疗效的临床试验奠定基础。Kmiec 博士说,在试验推进之前,他希望他的团队开发一个明确的流程,用于识别和评估 CRISPR 编辑的所有结果。
识别和理解基因编辑过程中产物结果的多样性一直是该基因编辑研究所建立以来的核心基础研究项目。
安全地使用 CRISPR
Kmiec 博士表示:“我们以客观无偏的方式进行实验,把患者的安全和治疗的有效性作为我们科学研究所努力的指导方向。” Kmiec 博士说,“无论我们发现或阐明什么,它们都将帮助 ChristianaCare 研究所以及整个领域以更安全和更有效的方式去使用 CRISPR。”
研究人员在多个细胞中发现,NRF2基因中的目标DNA编码链并没有被完全破坏。相反,经过 CRISPR 编辑之后,一些保留了足够的原始编码,并可以继续产生另一种形式蛋白质的细胞出现了。试验表明,产生这些变异蛋白质的癌症肿瘤细胞可能更容易受到化疗药物的攻击。
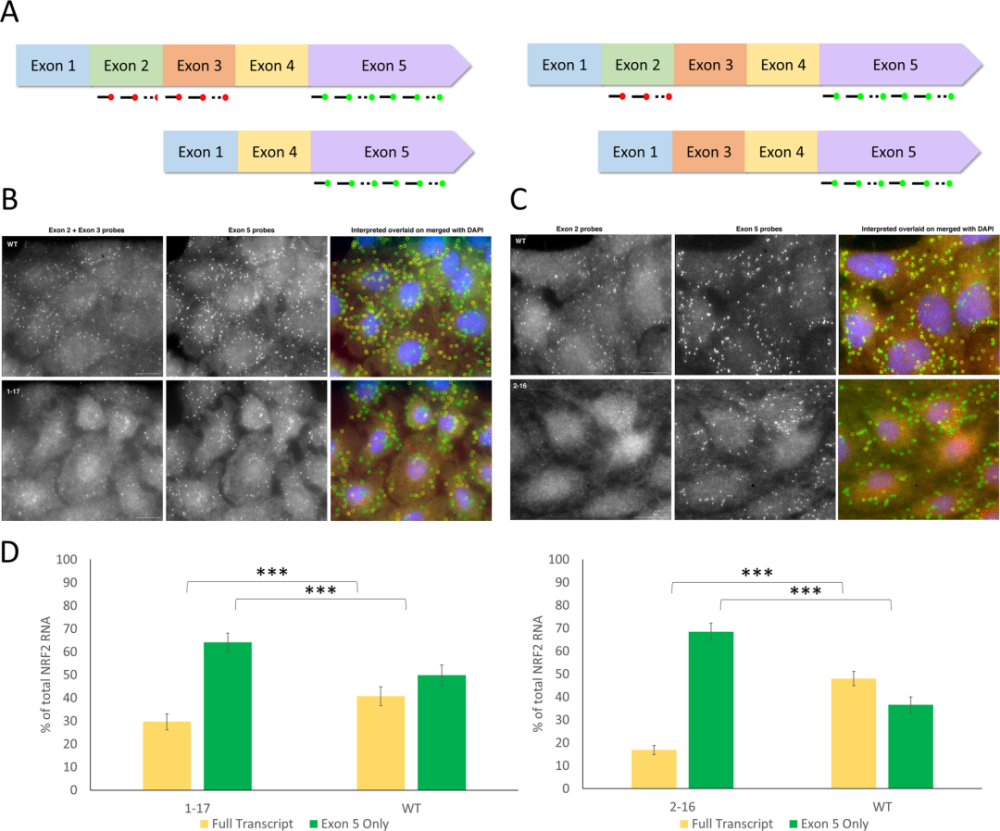
通过 smFISH 成像检测改变的 NRF2 转录物 | 参考文献[1]
文章第一作者 Kelly Banas 博士说:“对于我们围绕 NRF2 所展开的工作,CRISPR 编辑后产生的删节版蛋白似乎使肿瘤细胞对治疗更加敏感。但关键是这些蛋白显然具有生物活性,这意味着我们需要确定它们对使用 CRISPR 治疗肺癌患者的安全性和有效性所产生的的潜在影响。”
Banas 博士指出,这项研究指出了原本仅仅通过确认原始目标蛋白质形式缺失就认为 CRISPR 编辑成功这一检测标准的局限性。她说,如果按照这个标准,他们的基因编辑是成功的。经过编辑的 NRF2 基因不再产生原始形式的蛋白质。但是她又补充说,如果 ChristianaCare 研究小组所追求的目标就是这些,那么他们就会忽略 NRF2 基因改变后产生的变异蛋白质,从而忽略一个重要的结果。在这种情况下,这个结果完善了最初的假设和实验方法,即:使用 CRISPR 靶向编辑 NRF2 基因改善肺癌患者的治疗结果。
尽职调查的重要性
Kmiec 博士说:“我们在这项研究中描述的过程应该作为一个在任何将 CRISPR 作为一种药物治疗的努力中都应该遵循的模板。作为医疗保健机构的从业者,保证病人安全是我们的首要任务。我们同时也在令人兴奋的尖端医学领域发挥着先锋作用,在这个领域,如果不执行严格尽职调查,那么有可能会导致使这个领域倒退数十年的悲剧性后果。通过这项研究,我们验证了一个可以帮助这一领域快速而安全地向前发展的过程。”
CRISPR 代表“规律间隔成簇短回文重复序列”,它是一种在细菌中发现的防御机制,可以识别并切除入侵病毒的病毒 DNA 序列。科学家们已经学会了如何修改这种机制,使其能够被引导去“编辑”特定的 DNA 编码序列。
参考文献
[2] https://www.eurekalert.org/news-releases/946824
编译:茵陈
编辑:酥鱼
排版:尹宁流
题图来源:站酷海洛
研究团队
通讯作者Eric B. Kmiec:因其在分子医学和基因编辑领域的开创性工作而闻名。自2014年以来,任基因编辑研究所所长。在他的职业生涯中,Kmiec博士一直领导着研究人类细胞中基因编辑的反应机制、生物化学和分子遗传学的研究团队。他早期在镰状细胞疾病方面的工作带领了新一代基因编辑工具的研究和开发,包括 CRISPRs 和更有前景的变体,如用于治疗遗传性疾病的单链DNA寡核苷酸(ssODNs)。
第一作者Kelly Banas:研究员,她的研究兴趣是开发和评估非小细胞肺癌的新型基因编辑策略。她目前的重点是用CRISPR基因编辑工具针对癌症特定的NRF2突变,并评估这些特定的靶向策略对受影响和邻近细胞的短期和长期影响。凯利在肿瘤细胞内发现了一个独特的CRISPR靶点,而这个靶点在肿瘤周围的正常细胞中是不存在的,这为通过CRISPR指导的基因编辑来治疗实体瘤建立了一个创新的基础方法。她最近向美国食品和药物管理局提交了她的主要研究结果,她的发现促成了一项临床方案的制定。她于2021年毕业于特拉华大学,获得分子医学博士学位。
课题组网站
https://christianacare.org/people/eric-kmiec-phd/
如果想了解更多产业界和科技创投资讯,
欢迎关注果壳硬科技