健康時報記者 邱越
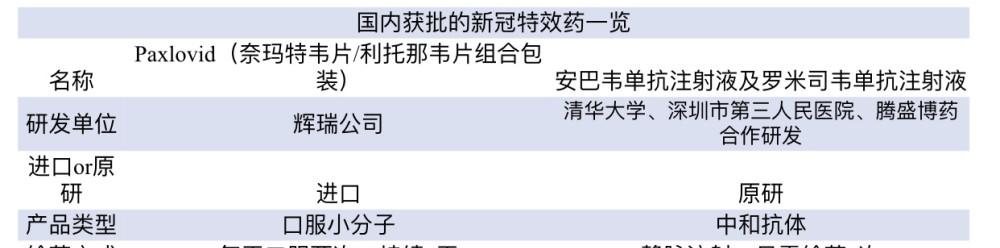
2月11日,國家藥監局附條件準許了美國輝瑞公司新冠病毒治療藥物奈瑪特韋片/利托那韋片組合包裝(即Paxlovid)進口注冊。這是國内上市的第一款口服新冠藥物,也是迄今為止國内上市的第二款新冠治療藥物。
2021年12月8日,國家藥品監督管理局應急準許騰盛華創醫藥技術(北京)有限公司新冠病毒中和抗體聯合治療藥物安巴韋單抗注射液(BRII-196)及羅米司韋單抗注射液(BRII-198)注冊申請。
國内患者何時能用上新冠特效藥呢?2月14日,健康時報記者分别聯系了輝瑞和騰盛博藥。
制圖:邱越
國内第一個口服新冠藥物:上市消息将及時公布
據國家藥監局介紹,Paxlovid為口服小分子新冠病毒治療藥物,用于治療成人伴有進展為重症高風險因素的輕至中度新型冠狀病毒肺炎(COVID-19)患者,例如伴有高齡、慢性腎髒疾病、糖尿病、心血管疾病、慢性肺病等重症高風險因素的患者。
2月14日,健康時報記者從輝瑞公司獲悉,目前Paxlovid剛剛獲批,具體的上市計劃尚不掌握,若想知道藥品何時上市、在什麼城市的哪些醫院落地等資訊,還需等待一些時日。有消息将第一時間公布。
圖檔源自新華社。
根據美國食品藥品監督管理局(FDA)的提示,Paxlovid由奈瑪特韋片(nirmatrelvir)和利托那韋片(ritonavir)組成,奈瑪特韋片可以抑制SARS-CoV-2蛋白的複制,而利托那韋片可以減緩奈瑪特韋片的分解,幫助藥物在更高濃度下更長時間地留在體内。治療時服用三片藥,即兩片奈瑪特韋片和一片利托那韋片,每天口服兩次,持續5天,且不能連續使用超過5天。
美國食品藥品監督管理局在一份聲明中強調,對于那些建議接種新冠病毒疫苗和加強劑量的個人來說,Paxlovid不能替代疫苗接種。
臨床試驗數顯示,與安慰劑相比,在症狀出現的三天内(主要終點),接受Paxlovid治療的成人與COVID-19相關的住院或因任何原因死亡的風險降低了89%。在症狀出現後5天内接受治療的患者(次要終點)中,住院或因任何原因死亡的風險降低了88%,并且在治療組中沒有觀察到死亡。
國内首款新冠單克隆中和抗體:正在推進生産供應事宜
2021年12月8日,國家藥品監督管理局應急準許騰盛華創醫藥技術(北京)有限公司新冠病毒中和抗體聯合治療藥物安巴韋單抗注射液(BRII-196)及羅米司韋單抗注射液(BRII-198)注冊申請,準許上述兩個藥品聯合用于治療輕型和普通型且伴有進展為重型(包包覆院或死亡)高風險因素的成人和青少年(12—17歲,體重≥40kg)新型冠狀病毒感染(COVID-19)患者。其中,青少年(12—17歲,體重≥40kg)适應症人群為附條件準許。
2月14日,健康時報記者從騰盛華創獲悉,該公司正積極推進生産及供應工作,以盡早實作藥物上市,以惠及新冠患者。
安巴韋單抗和羅米司韋單抗是大陸首家獲批的自主知識産權新冠病毒中和抗體聯合治療藥物,由清華大學、深圳市第三人民醫院及騰盛博藥生物科技公司合作研發。
企業供圖。
2021年12月4日,騰盛華創獲得了三期臨床試驗全部受試者的資料。最終結果顯示,與安慰劑相比,該聯合療法使臨床為高風險的新冠門診患者住院和死亡風險降低80%,并且藥品臨床安全性優于安慰劑組。目前的體外嵌合病毒實驗檢測資料表明,該聯合療法對奧密克戎、德爾塔、德爾塔+、阿爾法、貝塔、伽馬、拉姆達等新冠病毒變異株均保持了中和活性。
清華大學醫學院教授張林琦在産品釋出會上表示,無論早期即開始接受治療(症狀出現後5天内)還是晚期才開始接受治療(症狀出現後6至10天内)的受試者,住院和死亡率均顯著降低,這為新冠患者提供了更長的治療視窗期。
據騰盛博藥提供的資訊,新冠病毒主要通過與人體細胞上的ACE2結合感染人體細胞,并通過細胞繁殖造成疾病。安巴韋單抗針對新冠病毒受體結合區域與ACE2直接結合的部位,阻斷病毒與ACE2結合。而羅米司韋單抗針對新冠病毒受體結合區域另一個不與ACE2結合的位點,以不同作用機制阻斷病毒的繁殖。據悉,該中和抗體聯合療法采用靜脈注射的方式,一次注射時間約1小時左右,隻需一次給藥即完成治療。
此外,鐘南山院士帶領的廣州實驗室團隊正在開展安巴韋單抗和羅米司韋單抗聯合療法用于預防的研究工作,推動其在疫苗反應欠佳人群中的預防使用。