前情提要
2021年10月4日,備受矚目的諾貝爾生理學或醫學獎終于揭曉,頒發給了David Julius和Ardem Patapoutian,以表彰他們發現了溫度感覺和觸覺受體 (Transient receptor potential ion channel),揭示我們感覺世界的奧秘。
回首2012年,Robert J. Lefkowitz和Brian K. Kobilka因“G蛋白偶聯受體研究”獲得了諾貝爾化學獎。2003年,Peter Agre與Roderick Mackinnon因離子通道的研究獲得了諾貝爾化學獎。這三次諾貝爾獎,巧合的是它們都間隔了9年,都垂青于膜蛋白研究。
膜蛋白作為主要的生理傳感器,涵蓋了視覺、嗅覺、溫度和壓力感覺等衆多受體,涉及生理過程範圍之廣,以及在科學界所受關注度之高,使其成為了藥物開發領域的重要靶點。
目前上市的所有藥物中有50%以上是由人類膜蛋白組成的。GPCRs(G-protein coupled receptors,G蛋白偶聯受體)是人體中最大的膜蛋白家族。
接下來,小編将重點為您介紹GPCRs的結構、信号通路、靶向藥物各階段的開發格局。ACROBiosystems突破GPCRs抗原制備難點,可提供全長GPCRs抗原,助力抗體開發,值得推薦。
<h1 class="pgc-h-arrow-right" data-track="7">GPCRs結構</h1>
GPCRs的共同分子結構由7個跨膜α螺旋組成,這些結構域将受體分割為胞外N端,胞内C端,3個胞外環和3個胞内環。胞外環上包含有兩個高度保守的半胱氨酸殘基,它們可以通過形成二硫鍵穩定受體的空間結構。胞内環上有G蛋白結合位點。以CCR5為例,經典的GPCRs拓撲結構如下圖所示。
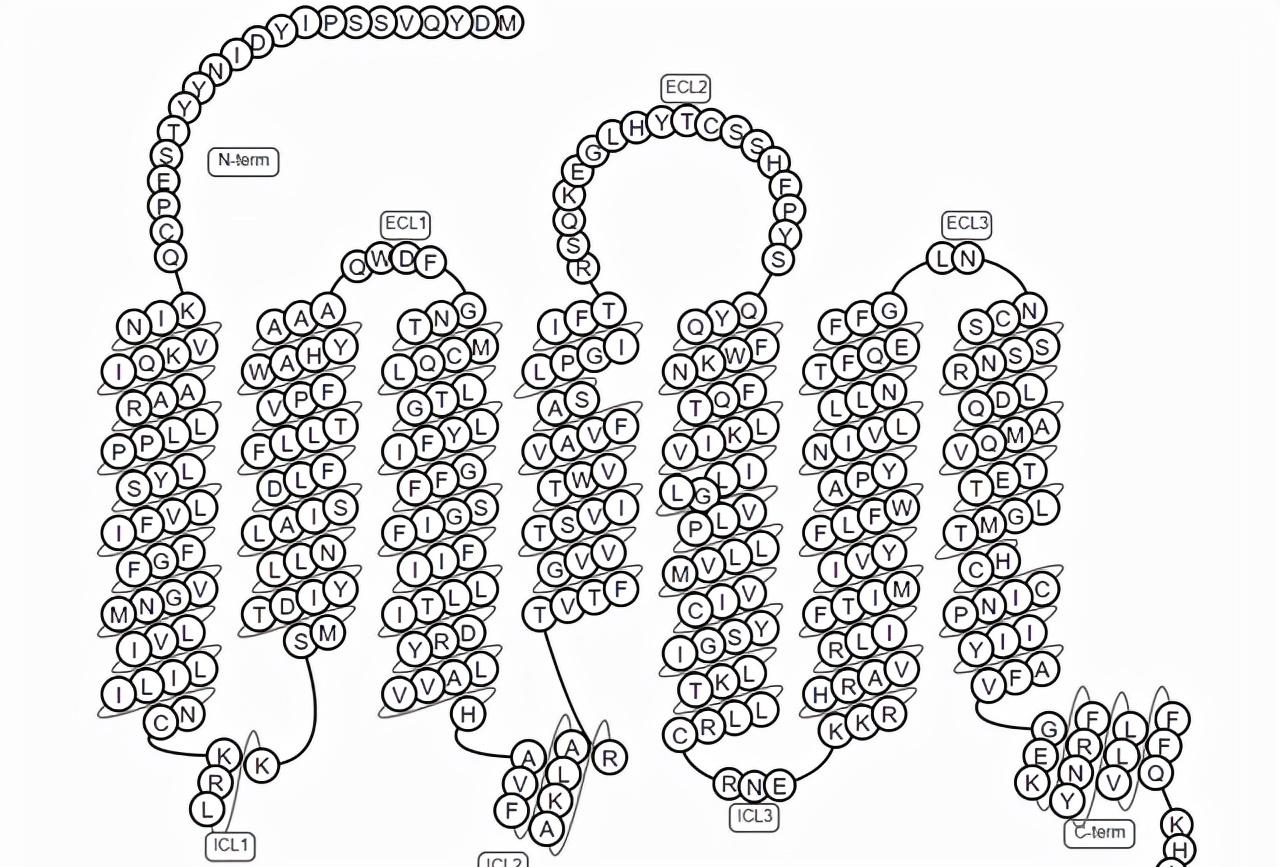
圖1. 經典的GPCRs拓撲結構示意圖
<h1 class="pgc-h-arrow-right" data-track="11">GPCRs的信号機制</h1>
G蛋白是在信号轉導過程中,與GPCRs偶聯并能與鳥苷酸結合的一類蛋白,位于細胞膜胞質内,由α、β和γ三種亞機關組成的三聚體。G蛋白主要功能是通過自身構象的變化激活效應蛋白,進而實作信号由胞外向胞内的傳遞。在靜息狀态下,GPCRs不結合配體,胞質中的αβγ三聚體與GDP (Guanosine diphosphate) 結合,并與受體分離,無活性。當配體與GPCRs結合,GPCRs與G蛋白α亞基結合的位點暴露,并與之互相作用,導緻α亞基構象改變,與GDP親和力減弱,與GTP (Guanosine triphosphate) 親和力增強。此時GDP-αβγ複合物在Mg參與下,結合的GDP與胞質中GTP交換,形成GTP-αβγ複合物。随後G蛋白被激活,并與受體分離,同時解體為GTP-α與βγ兩部分,這兩個分子沿着細胞膜自由擴散,直接與細胞膜下遊的效應蛋白作用,導緻效應體激活和啟動第二信使級聯,完成信号從胞外傳遞到胞内。當配體與受體結合解除後,α亞機關本身具有GTP酶活性,能促使GTP水解為GDP,再與βγ亞機關形成G蛋白三聚體恢複原來的靜息狀态。G蛋白下遊信号蛋白通常是離子通道或與膜結合的酶,通常為腺苷酸環化酶和磷脂酶C等。
圖2:GPCRs信号通路
GPCRs存在于體内所有的細胞中,能偶聯多種配體,包括離子、神經遞質、糖類、脂質、内源性多肽、蛋白酶等生物大分子,通過激活G蛋白和其他信号分子參與衆多生理過程,包括肌肉收縮和松弛、神經信号傳遞、免疫系統調節及機體整體代謝等。GPCRs也是人體内最大的成藥家族,涉及的疾病主要包括惡性良性腫瘤、自身免疫、神經系統疾病、心血管疾病等,是以,GPCRs是治療多種疾病的優秀的藥物靶點。
<h1 class="pgc-h-arrow-right" data-track="15">靶向GPCRs藥物開發進展</h1>
GPCRs作為藥理學靶點一直備受關注。2011-2015年,針對GPCRs的藥物總銷售額約為8900億美元,占全球治療藥物市場佔有率的27%。GPCRs中除了大約一半的嗅覺受體外,尚有227種(57%)非嗅覺受體處于未開發狀态,仍具有廣泛治療潛力,特别是在遺傳和免疫系統疾病方面。
2017年,有調查資料顯示,以GPCRs為靶點的治療藥物有481種,約占FDA準許的所有藥物的34%,共涉及107個獨特的GPCRs。其中大約有320種藥物正在進行臨床試驗,約35%的藥物靶向64個潛在的新GPCRs靶點。
在以GPCRs為靶點的藥物開發領域中,GPCRs抗體相對于小分子藥物具有獨特的優勢:
體内的清除率更低,作用時間更長,相應的給藥頻率更低;
抗體的選擇性明顯優于小分子;
由于血腦屏障的阻隔,抗體藥物無法進入中樞神經,是以對于在外周和中樞神經系統均有表達的GPCRs,若隻需針對外周的部分設計藥物,則可以開發治療性抗體,使藥物主要分布在外周區域,降低對中樞神經系統的毒副作用。
圖3:GPCRs臨床藥物靶點分布
目前全球範圍内處于活躍狀态的GPCRs靶向抗體大約有14個,靶點分别是CCR4、CGRPR、CCR5、GCGR、GPRC5D、GLP1R、C5AR、CB1、S1PR1、CCR8、CCR7、GPR49、AGTR1。比較有代表性的藥物是Leronlimab,一種靶向CCR5的人源化IgG4單克隆抗體,是一種HIV病毒進入抑制劑。通過掩蓋CCR5,阻斷HIV(R5)亞型進入健康T細胞,進而保護這些細胞免受病毒感染。
靶向GPCRs藥物資訊(Clarivate資料庫)
<h1 class="pgc-h-arrow-right" data-track="25">ACROBiosystems助力靶向GPCRs抗體開發</h1>
制備抗體的第一步就是抗原免疫,而免疫的第一步就是抗原的制備。由于GPCRs類靶點胞外露出部分有限、細胞表面表達低、蛋白聚集等因素,導緻想要獲得具有生物學活性的可溶性GPCRs抗原極其困難,這也成為了GPCRs藥物研發的瓶頸。要獲得全長天然的GPCRs抗原用于藥物研發,則需要突破兩個瓶頸:
表達量的提升。大部分膜蛋白在細胞膜上的表達量非常小,有的甚至是僅在細胞周期的某個短時間内表達。同時,不同于分泌型蛋白,膜蛋白的表達和展示受限于膜面積,另外,由于很多膜蛋白涉及到物質轉運和信号傳遞相關的功能,其在細胞膜上過量表達會對細胞造成不可逆的傷害,膜蛋白的這些特性極大地限制了其表達量。是以,要獲得足量的用于免疫和藥物研發的全長膜蛋白,需要在表達區間、表達體系、培養條件等多方面進行設計和優化,即便如此,獲得毫克級的膜蛋白的成本仍然遠遠高于可溶蛋白。
在表達和純化的過程中保持膜蛋白的均一性和活性。膜蛋白的跨膜結構域是高度疏水的,是以無保護的暴露在水環境下将導緻非特異性蛋白聚集甚至變性,是以,在針對膜蛋白的富集和純化的過程中,需要始終維持膜蛋白周圍環境的親疏水特性。目前常用的方法是通過去垢劑将膜蛋白從磷脂雙分子層細胞膜上抽提出來,并形成膠束,以盡可能保持其天然構象和功能活性,同時也有諸如建構納米盤(Nanodiscs)、病毒樣顆粒(Virus-like particles, VLP)、聚合物脂質顆粒(polymer lipid particle, PoLiPa)等方法用于膜蛋白的重構和功能研究。
為助力靶向GPCRs藥物研究,ACROBiosystems專門搭建了VLP、膜蛋白-去垢劑、Nanodisc平台化解決方案,提供全長GPCRs蛋白,如GPRC5D、CCR5、CCR8等,可用于免疫、ELISA、SPR、BLI等場景。
除GPCRs之外,ACROBiosystems可以提供種類齊全的全長多次跨膜蛋白,包括四次跨膜蛋白CD20、Claudin18.2,五次跨膜蛋白CD133,更多全長蛋白正在開發中,敬請關注和咨詢。
參考文獻
1. Dong HF, Wigmore K, Carrington MN, Dean M, Turpin JA, Howard OM. Variants of CCR5, which are permissive for HIV-1 infection, show distinct functional responses to CCL3, CCL4 and CCL5. Genes Immun. 2005 Oct;6(7):609-19. doi: 10.1038/sj.gene.6364247. PMID: 16015368; PMCID: PMC1369982.
2. Hanlon CD, Andrew DJ. Outside-in signaling--a brief review of GPCR signaling with a focus on the Drosophila GPCR family. J Cell Sci. 2015 Oct 1;128(19):3533-42. doi: 10.1242/jcs.175158. Epub 2015 Sep 7. PMID: 26345366; PMCID: PMC4610211.
3. Hauser AS, Attwood MM, Rask-Andersen M, Schith HB, Gloriam DE. Trends in GPCR drug discovery: new agents, targets and indications. Nat Rev Drug Discov. 2017 Dec;16(12):829-842. doi: 10.1038/nrd.2017.178. Epub 2017 Oct 27. PMID: 29075003; PMCID: PMC6882681.
4. Wiseman DN, Otchere A, Patel JH, Uddin R, Pollock NL, Routledge SJ, Rothnie AJ, Slack C, Poyner DR, Bill RM, Goddard AD. Expression and purification of recombinant G protein-coupled receptors: A review. Protein Expr Purif. 2020 Mar;167:105524. doi: 10.1016/j.pep.2019.105524. Epub 2019 Oct 31. PMID: 31678667; PMCID: PMC6983937.
5. McLean MA, Gregory MC, Sligar SG. Nanodiscs: A Controlled Bilayer Surface for the Study of Membrane Proteins. Annu Rev Biophys. 2018 May 20;47:107-124. doi: 10.1146/annurev-biophys-070816-033620. Epub 2018 Mar 1. PMID: 29494254; PMCID: PMC6370528.
6. Ho TT, Nguyen JT, Liu J, Stanczak P, Thompson AA, Yan YG, Chen J, Allerston CK, Dillard CL, Xu H, Shoger NJ, Cameron JS, Massari ME, Aertgeerts K. Method for rapid optimization of recombinant GPCR protein expression and stability using virus-like particles. Protein Expr Purif. 2017 May;133:41-49. doi: 10.1016/j.pep.2017.03.002. Epub 2017 Mar 3. PMID: 28263854.
7. Hothersall JD, Jones AY, Dafforn TR, Perrior T, Chapman KL. Releasing the technical 'shackles' on GPCR drug discovery: opportunities enabled by detergent-free polymer lipid particle (PoLiPa) purification. Drug Discov Today. 2020 Aug 21:S1359-6446(20)30337-8. doi: 10.1016/j.drudis.2020.08.006. Epub ahead of print. PMID: 32835806.
敬請關注“ACROBiosystems官方”,有任何問題歡迎留言或私信小編。