熱力學第一定律
ΔU=Q+W (熱力學能隻是溫度函數 U=f(T),改變值與變化途徑無關)
等壓體積功:W= -p(V2-V1) → dU=dQ – pdV
準靜态過程:内外壓力無限小的膨脹和壓縮過程就是準靜态過程,在膨脹過程中系統做最大功,在壓縮過程中環境對系統做最小功。兩者數值相等,符号相反。
焓: H=U+pV ; ΔH=Qp 推導過程:U2-U1=Qp-p(V2-V1) → Qp=(U2+pV2)-(U1+pV1) 意義:系統在等壓過程中所吸收的熱,全部用于使焓增加。焓和熱力學能一樣僅以溫度為函數,而與p、V無關。在等容過程時,ΔU=Qv,計算公式:ΔH=Qv-pΔV
ΔrHθm:在标準态下(100Kpa、298.15K),反應進度為1mol時的反應就稱為标準摩爾焓變,用ΔrHθm(T)表示。
ΔfHθm:在标準壓力100Kpa下,、298.15K),由穩定單質生成1mol純淨物的焓變稱為該純淨物的标準摩爾生成焓。ΔrHθm(298.15K)=∑vBΔfHθm(B, 298.15K)
ΔcHθm:在标準态下(100Kpa、298.15K),機關量1mol的物質完全氧化為同溫下的指定産物時的标準摩爾焓變稱為該物質的标準摩爾燃燒焓。ΔrHθm(298.15K)= -∑vBΔcHθm(B, 298.15K)
熱力學第二定律
熵(S):熵是狀态函數,反映了質點運動的混亂程度。系統混亂度越大,熵值也越大。任何純淨的完美晶體在絕對零度時的熵值為零。判據:ΔS≥0, =0可逆,>0不可逆。
适用範圍:隔離系統或絕熱系統。
Helmholtz自由能(A):在等溫過程中,一個封閉系統所能做的最大功等于其Helmholtz自由能的減少。判據:A=U-TS ΔA≤0,适用範圍:等溫、等容不做其他功。
Gibbs吉布斯(G):在等溫、等壓條件下,一個封閉系統所能做的最大非膨脹功等于其Gibbs自由能的減少。判據: G=H-TS ΔG≤0, 适用範圍:等溫、等壓不做其他功。
多組分系統
偏摩爾量:在均勻的多組分系統中,系統的某種容量性質不等于各個純組分的該種容量性質之和,但是各組分廣度性質的偏摩爾量與其物質的量之乘積具有加和性。
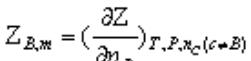
編輯
添加圖檔注釋,不超過 140 字(可選)
。實體意義是在等溫、等壓條件下,保持除B以外的其他組分的數量不變,加入1molB時是以所引起該系統容量性質Z的改變。
加和公式:V=n1V1+n2V2 系統的總體積等于各組分偏摩爾體積V1和V2與其物質的量的乘積之和。
相平衡
相律:f+Φ=(S-R-R’)+2 令 C= S-R-R’,C稱為組立組分數, 表達式為f+Φ=C+2
單組分系統兩相平衡:C=1,Φ=1時,f=2 ; Φ=2,則 f=1。
二組分系統的相圖及其應用:C=2, f=4-Φ,自由度至多為3。注意p-x圖和T-x圖,最大自由度2,同時共存相數最多3。
正偏差很大,蒸汽壓越高,沸點越低,在p-x圖上有最高點,在T-x圖上有最低點,這個最低點就是最低恒沸點。負偏差很大,則反之。
n (1)NH4Cl(s)==NH3(g)+HCl(g) C= S-R-R’=3-1-1=1 Φ=2 f= C+2-Φ=1
(2) C= S-R-R’=3-1-0=2 Φ=2 f= C+2-Φ=2 (3) NH4HS(s)==NH3(g)+H2S(g) 結果同上 (4) C(s)+1/2O2(g)==CO(g);CO(g)+1/2O2(g)==CO2(g);C(s)+O2(g)==CO2(g);C(s)+CO2(g)==2CO(g) 實際存在兩個獨立化學平衡式C= S-R-R’=4-2-0=2 Φ=2 f(900K)=C+1-Φ=1
n (1)OA是金剛石與石墨的晶形轉變溫度歲壓力變化的曲線,線上兩相平衡共存。OB是石墨的熔點随壓力變化的曲線,線上上石墨與液态碳兩相平衡共存。OC是金剛石的熔點随壓力變化的曲線,線上上金剛石與液态碳兩相平衡。(2)O點是金剛石石墨及液态碳的三相平衡點,自由度f=0 (3)在常溫常壓下,石墨更穩定。(4)2000K時,石墨摩爾體積大于金剛石摩爾體積(5)由圖可知,需要5*10^9Pa以上的壓力。
編輯切換為居中
(3)
電解質溶液
可逆電池的電動勢
4.用書面表示電池時有哪些通用符号?為什麼電極電勢有正有負?用實驗能測到負的電動勢嗎?
化學動力學
反應速率:反應進度随時間的變化率
反應物取-,生成物取+
基元反應:一步完成的反應
速率方程:表示速率與濃度等參數的關系
K為速率常數;級數=a+b
零級反映特征:濃度*時間-1、CA=CAo-kt、t1/2=CAo/2k
一級反應特征:時間-1 、InCA=InCAo-kt 其中InCA-t成直線性、判斷t1/2=In2/k=0.693/k
二級反應特征:濃度-1時間-1、1/CA-t直線、t1/2=1/KCAo
表面實體化學
表面張力:液體中分子有把表面收縮到最小的趨勢。F=2γl(γ為表面張力)
γ又可稱為比表面Gibbs自由能,指的是每增加機關表面積,Gibbs自由能的增值。
無機鹽,不揮發酸堿等增加表面張力,能使水的表面張力降低的溶質都是有機化合物。
附加壓力:平衡時,作用于邊界的力将有一合力,液面為凸性時,指向液體内部,反之,外部。附加壓力的方向是指向曲面的圓心。表面積越小,球越穩定
蒸汽壓:
表明液滴越小,蒸汽壓越大。
表面吸附:表面上一層薄膜濃度總是與内部不同。表面積縮小和張力降低都會降低自由能。。