热力学第一定律
ΔU=Q+W (热力学能只是温度函数 U=f(T),改变值与变化途径无关)
等压体积功:W= -p(V2-V1) → dU=dQ – pdV
准静态过程:内外压力无限小的膨胀和压缩过程就是准静态过程,在膨胀过程中系统做最大功,在压缩过程中环境对系统做最小功。两者数值相等,符号相反。
焓: H=U+pV ; ΔH=Qp 推导过程:U2-U1=Qp-p(V2-V1) → Qp=(U2+pV2)-(U1+pV1) 意义:系统在等压过程中所吸收的热,全部用于使焓增加。焓和热力学能一样仅以温度为函数,而与p、V无关。在等容过程时,ΔU=Qv,计算公式:ΔH=Qv-pΔV
ΔrHθm:在标准态下(100Kpa、298.15K),反应进度为1mol时的反应就称为标准摩尔焓变,用ΔrHθm(T)表示。
ΔfHθm:在标准压力100Kpa下,、298.15K),由稳定单质生成1mol纯净物的焓变称为该纯净物的标准摩尔生成焓。ΔrHθm(298.15K)=∑vBΔfHθm(B, 298.15K)
ΔcHθm:在标准态下(100Kpa、298.15K),单位量1mol的物质完全氧化为同温下的指定产物时的标准摩尔焓变称为该物质的标准摩尔燃烧焓。ΔrHθm(298.15K)= -∑vBΔcHθm(B, 298.15K)
热力学第二定律
熵(S):熵是状态函数,反映了质点运动的混乱程度。系统混乱度越大,熵值也越大。任何纯净的完美晶体在绝对零度时的熵值为零。判据:ΔS≥0, =0可逆,>0不可逆。
适用范围:隔离系统或绝热系统。
Helmholtz自由能(A):在等温过程中,一个封闭系统所能做的最大功等于其Helmholtz自由能的减少。判据:A=U-TS ΔA≤0,适用范围:等温、等容不做其他功。
Gibbs吉布斯(G):在等温、等压条件下,一个封闭系统所能做的最大非膨胀功等于其Gibbs自由能的减少。判据: G=H-TS ΔG≤0, 适用范围:等温、等压不做其他功。
多组分系统
偏摩尔量:在均匀的多组分系统中,系统的某种容量性质不等于各个纯组分的该种容量性质之和,但是各组分广度性质的偏摩尔量与其物质的量之乘积具有加和性。
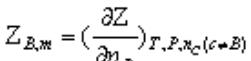
编辑
添加图片注释,不超过 140 字(可选)
。物理意义是在等温、等压条件下,保持除B以外的其他组分的数量不变,加入1molB时所以所引起该系统容量性质Z的改变。
加和公式:V=n1V1+n2V2 系统的总体积等于各组分偏摩尔体积V1和V2与其物质的量的乘积之和。
相平衡
相律:f+Φ=(S-R-R’)+2 令 C= S-R-R’,C称为组立组分数, 表达式为f+Φ=C+2
单组分系统两相平衡:C=1,Φ=1时,f=2 ; Φ=2,则 f=1。
二组分系统的相图及其应用:C=2, f=4-Φ,自由度至多为3。注意p-x图和T-x图,最大自由度2,同时共存相数最多3。
正偏差很大,蒸汽压越高,沸点越低,在p-x图上有最高点,在T-x图上有最低点,这个最低点就是最低恒沸点。负偏差很大,则反之。
n (1)NH4Cl(s)==NH3(g)+HCl(g) C= S-R-R’=3-1-1=1 Φ=2 f= C+2-Φ=1
(2) C= S-R-R’=3-1-0=2 Φ=2 f= C+2-Φ=2 (3) NH4HS(s)==NH3(g)+H2S(g) 结果同上 (4) C(s)+1/2O2(g)==CO(g);CO(g)+1/2O2(g)==CO2(g);C(s)+O2(g)==CO2(g);C(s)+CO2(g)==2CO(g) 实际存在两个独立化学平衡式C= S-R-R’=4-2-0=2 Φ=2 f(900K)=C+1-Φ=1
n (1)OA是金刚石与石墨的晶形转变温度岁压力变化的曲线,线上两相平衡共存。OB是石墨的熔点随压力变化的曲线,在线上石墨与液态碳两相平衡共存。OC是金刚石的熔点随压力变化的曲线,在线上金刚石与液态碳两相平衡。(2)O点是金刚石石墨及液态碳的三相平衡点,自由度f=0 (3)在常温常压下,石墨更稳定。(4)2000K时,石墨摩尔体积大于金刚石摩尔体积(5)由图可知,需要5*10^9Pa以上的压力。
编辑切换为居中
(3)
电解质溶液
可逆电池的电动势
4.用书面表示电池时有哪些通用符号?为什么电极电势有正有负?用实验能测到负的电动势吗?
化学动力学
反应速率:反应进度随时间的变化率
反应物取-,生成物取+
基元反应:一步完成的反应
速率方程:表示速率与浓度等参数的关系
K为速率常数;级数=a+b
零级反映特征:浓度*时间-1、CA=CAo-kt、t1/2=CAo/2k
一级反应特征:时间-1 、InCA=InCAo-kt 其中InCA-t成直线性、判断t1/2=In2/k=0.693/k
二级反应特征:浓度-1时间-1、1/CA-t直线、t1/2=1/KCAo
表面物理化学
表面张力:液体中分子有把表面收缩到最小的趋势。F=2γl(γ为表面张力)
γ又可称为比表面Gibbs自由能,指的是每增加单位表面积,Gibbs自由能的增值。
无机盐,不挥发酸碱等增加表面张力,能使水的表面张力降低的溶质都是有机化合物。
附加压力:平衡时,作用于边界的力将有一合力,液面为凸性时,指向液体内部,反之,外部。附加压力的方向是指向曲面的圆心。表面积越小,球越稳定
蒸汽压:
表明液滴越小,蒸汽压越大。
表面吸附:表面上一层薄膜浓度总是与内部不同。表面积缩小和张力降低都会降低自由能。。