CRISPR/Cas9技術是一種屢獲殊榮的基因編輯工具。由于其高效率和精準的基因組修飾,它可以在生命科學領域實作惡性良性腫瘤、遺傳病和傳染病等重大疾病的治療。然而,缺乏合适的遞送系統也限制了CRISPR/Cas9技術的臨床應用,是以該領域的研究也值得關注。
在《學術線上》第12期中,我們邀請了浙江大學教授、博士生導師袁平教授與我們分享基因編輯非病毒載體在疾病治療中的應用。
基因編輯技術
基因編輯可精确地破壞、插入或替換基因組中特定位點的DNA序列,在基因功能的研究和遺傳病的治療中起着重要作用。由工程内切酶(EEN)介導的基因編輯技術大大改善了基于同源重組的早期基因靶向技術的低效率,使研究人員能夠有效地編輯各種細胞類型和生物體的任何基因。
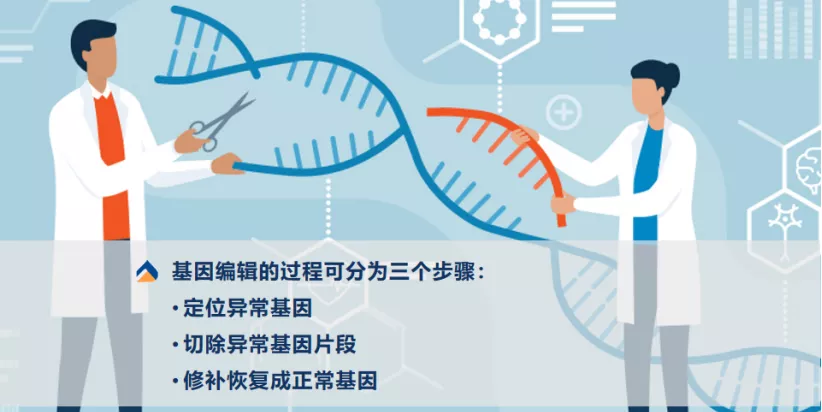
圖|基因編輯過程中的三個步驟
目前,有巨核酸酶、鋅指核酸酶(ZFN)、轉錄激活因子樣效應核酸酶(序列化激活劑樣效應核酸酶N)、簇有規律間隔短回重複序列(CRISPR)等四種工具酶及其相關蛋白,是基因編輯技術中應用最多的。
無論是ZFN,TALEN還是CRISPR / Cas9,它們都由DNA鑒定結構域和核酸皮内酶組成,它們在結構上是相似的。ZFN技術具有識别靶DNA的鋅指結構域,而TALEN的DNA鑒定區域是典型系列TALE重複序列的中心結構域,DNA剪切區域是稱為Fokl的核酸内酶結構域。CrispR的DNA鑒定區域是crRNA或向導RNA,Cas9蛋白負責DNA的剪切。當DNA結合域識别靶DNA序列時,切皮核心酸酶或Cas9蛋白切割DNA,靶DNA雙鍊斷裂,然後激活DNA損傷修複機制,實作基因敲除、插入等。
圖|ZFN,TALEN,CRISPR靶向切割DNA比較
它們在行動過程中也是相似的。通過DNA鑒定子產品鑒定和鍵合特定的DNA位點,然後在相關核酸内裂解酶的作用下在特定位點進行切割,進而在細胞固有的HDR或NHEJ路徑修複過程的幫助下,以特定序列插入,删除和合并基因。
圖|ZEN,TALEN,CRISPR之間的差異比較
通過與其他技術進行比較,我們可以看到CRISPR/Cas9技術既有優勢也有局限性。那麼CRISPR/Cas9技術過去的生活有哪些故事呢?
基因編輯"魔術切割" - CRISPR
CRISPR于1987年由日本微生物學家Hiroshi Ishino首次發現。2012年Scribe Therapeutics的聯合創始人Jennifer Doudna博士和Emmanuelle Charpentier博士使用CRISPR編輯了他們的基因。CRISPR被認為是21世紀最重要的發現之一,在2012年、2013年和2015年三次被評為科學界的"世界十大科學突破"。
簇狀間隔短回聲重複序列(簇狀規則間隔短回文重複序列,CRISPR)是一種DNA重複序列,為細菌和古生物學提供對病毒和質粒的适應性免疫。CrispR基因序列主要由前導序列(前導序列)、重複序列和間隔序列(間隔序列)組成。2002年,Jansen的實驗室命名了與CRISPR位點(CRISPR相關)相鄰的基因,并發現了四個cas基因(cas1,cas2,cas3,cas4)。
CRISPR/Cas系統是原核生物的天然免疫系統。一些細菌在被病毒入侵後,能夠在DNA中存儲一小塊病毒基因,稱為CRISPR。當病毒再次入侵時,細菌可以根據它所寫的片段來識别病毒,切斷病毒的DNA并使其失效。
CrispR系統是I型,II型和III型,其中CRISPR / Cas9是研究最多的II型,是第3代基因編輯技術,遵循鋅指核酸酶(鋅指核酸酶,ZFN)和轉錄激活因子效應核酸酶(活化樣對象核酸酶,TALEN)。其介導的基因編輯可用于生成轉基因模型,調節轉錄,調節表觀遺傳學等。
CRISPR/Cas9系統主要由Cas9蛋白和單鍊向導RNA(sgRNA)組成,其中Cas9蛋白具有雙鍊切割DNA功能,sgRNA充當向導。在存在原間隔相鄰原型(PROtospacer相鄰基序,PAM)的情況下,Cas9蛋白可用于在sgRNA引導下通過堿基互補配對到達不同的靶位點,切割DNA雙鍊斷裂(雙斷裂,DSB)的靶基因。
CRISPR/Cas9技術工作的3個關鍵因素
向導RNA:定位部分靶基因RNA。這是在實驗室中設計的;
CRISPR相關蛋白9(Cas9):切斷"剪刀"不需要的DNA片段;
供體DNA:原始DNA鍊被切斷後插入所需的DNA片段。
圖|CRISPR - Cas9介導的基因組編輯圖
DSB修複有兩種主要機制,非同源連接配接端修複NHEJ和同源重組修複HDR。非同源末端連接配接(NHEJ),NHEJ介導的修複可以在DNA雙鍊斷裂位點産生不準确的可變長度插入和/或去除突變。還存在其他非同源重組修複途徑,例如微均質端連接配接(MMEJ,微同源介導端連接配接)和單鍊退火途徑(SSA,單鍊退火)。
NHEJ,MMEJ和SSA之間的差異在非同源修複的三種方式上是顯着的。
/ NHEJ途徑修複DSB損傷是通過直接連接配接末端來完成的,這不需要對大片段進行同源序列識别,但修複隻需要1-5 bp堿基配對,這是一種容易出現故障的修複。
MMEJ修複和NHEJ修複路徑之間最大的差別是所鑒定的同源序列的長度。MMEJ修複途徑需要5-25個堿基同源序列,這通常導緻連接配接處沒有同源片段或基因重生。這也是容易出錯的修複程式。
與NHEJ和MMEJ路徑相比,SSA途徑需要更長的同源序列(>30bp)進行鑒定。SSA通路可導緻基因組的喪失,這與MMEJ通路相似。此外,SSA與同源重組途徑類似,也被歸類為同源序列依賴性的DSB修複模式,兩者都需要5'至3'DNA剪切才能産生3'突出的單鍊DNA。
圖|非同源修複的三種方法
同源定向修複(HDR),HDR介導的精确修複可以引入精确的點突變或從單鍊或雙鍊DNA供體模闆插入突變。同源重組的機理在雙鍊DNA修複中具有重要的細胞生物學意義。DNA同源重組修複是一種複雜的信号通路,涉及多個步驟,關鍵蛋白為BRCA1和BRCA2。如果BRCA基因突變導緻BRCA1和BRCA2蛋白喪失能力,則可導緻HRD功能障礙(同源重組缺乏症,HRD)和PALB2,CDK12,RAD51,CHEK2,ATM等相關基因突變,或BRCA1基因啟動子甲基化,導緻基因組不穩定。當在同源重組中發生錯誤識别時,對非模闆染色體進行"修複"會對細胞造成不可預測的損傷。例如,錯誤的識别來自另一個親本同源對象,而不是姐妹染色單體作為"修複"受損染色體的模闆。親本和親本染色體的DNA序列在很多地方是不同的,是以這種類型的修複可以将需要修複的DNA序列從親本序列轉換到母體序列,或者從親本到母體序列。
圖|同源重組通常導緻基因DNA序列在染色體水準上互換
CrispR因其簡單、廉價和高效而成為世界上最受歡迎的基因編輯技術,被稱為編輯基因的"魔剪"。通過使科學家能夠高效、精确地改變、編輯或替換植物、動物甚至人類中的基因,修飾後的CRISPR技術可以廣泛應用于生物醫學等領域。
CRISPR技術在許多技術應用和互用領域産生了重大影響,人們越來越關注安全性、道德規範和監管。
CRISPR技術應用前景廣闊,有望在醫療保健、能源、農業和工業領域大放異彩
開發新的診斷測試,靶向藥物和治療方法。通過将CRISPR與其他可以切割靶DNA或RNA的Cas蛋白配對,然後切割其他分子以産生視覺信号,科學家可以确定病毒成分何時存在。科學家們正在利用這項技術開發診斷測試,以快速識别COVID-19等疾病。CRISPR / Cas9正在測試某些疾病的可能治療方法,包括鐮狀細胞性貧血和某些類型的癌症。CRISPR還可用于通過改變昆蟲或其他可以傳播它們的生物的特性來幫助控制某些疾病。例如,科學家使用CRISPR使蚊子對導緻瘧疾的寄生蟲更具抵抗力。
開發生物燃料。基因編輯可以提高藻類生物燃料的産量。使用CRISPR / Cas9技術,科學家們能夠找到并去除限制脂肪産生的基因。Synthetic Genomics是一家美國生物技術公司,緻力于為全球能源和環境問題開發商業基因組學解決方案,它創造了産生兩倍脂肪的藻類,然後用它們來生産生物柴油。到目前為止,藻類還沒有産生足夠高的脂肪來支援生物柴油的大規模生産。借助CRISPR / Cas9技術,藻類有望在将二氧化碳轉化為生物燃料方面顯着提高效率。Synthetic Genomics目前正在與石油公司埃克森美孚(Exxon Mobil)合作。預計到2025年,該夥伴關系将實作每天生産10,000桶(石油計量機關,相當于120至159升)藻類生物燃料的目标。
更強壯、更抗病的作物。CRISPR可以通過增加營養,抗病性和在惡劣天氣和土壤條件下的生存能力來改善農産品。在傳統作物改良中,CRISPR技術可以提高産量、品質、抗病性和除草劑抗性。CrispR在與其他技術相關的創新正在農業育種和加速作物馴化方面出現。目前,CRISPR技術廣泛應用于模型植物(變形蟲、煙草)和一些主要作物,如水稻、小麥、玉米等。CRISPR技術還促進了植物基因功能的研究和預期農藝性狀的選擇。例如,當研究人員去除少量特定的黃瓜基因時,這些植物就不那麼容易受到已知會損害植物并造成嚴重作物損失的病毒的影響。CRISPR的基因編輯和發明專家張峰教授、David Liu先生和Keith Joung先生共同創立了一家名為Pairwise的新農業公司。該公司緻力于利用基因編輯技術,通過利用作物的自然多樣性,以新的方式應對全球糧食挑戰。
更先進的工業産品。CrispR的潛在用途正在各行各業進行探索。除了開發新的生物燃料事故外,能夠拯救環境免受災害的細菌和新材料是工業産品與CRISPR技術結合使用的主要方向之一。Caribou Bioscience是一家專注于CRISPR非治療性應用的創新技術公司,提供基于CRISPR的工具,以改善工業發酵過程,并徹底改變化學品和酶的生産。他們還使用CRISPR來操縱微生物來産生新的化學物質。潛在的新型生物材料包括香料、香精和工業清潔産品。
圖|CRISPR技術應用前景與挑戰并存
CRISPR基因編輯也引發了人們對其安全性、倫理和監管的擔憂。
安全問題。使用CRISPR可能會産生意想不到的後果。例如,它可以針對DNA中的"意外"位置,導緻可能導緻疾病或其他傷害的變化。雖然一些研究表明錯誤可能很少見,但它們仍然需要研究。此外,CRISPR活性可能會給細胞帶來壓力并阻止編輯。雖然有些細胞可以在DNA改變後恢複,但許多細胞不能。
道德問題。倫理問題包括CRISPR是否會被用來增強人類的特征,比如增加肌肉品質、學習能力和記憶力,以及使用所有人群是否公平。使用CRISPR編輯人類生殖的影響也引發了倫理問題。例如,遺傳變化對後代的影響程度以及是否應該允許對人類胚胎進行研究。
監管挑戰。許多國家很難确定如何監管CRISPR和其他基因編輯技術。例如,在美國,目前尚不清楚基因編輯作物是否會受到與傳統轉基因(GM)生物相同的法規的限制。雖然FDA自2017年以來一直在就其監管政策征求公衆意見,但該技術的新行業指南已被推遲。在歐洲,2018年的一項法院裁決裁定,轉基因作物将受到與轉基因植物相同的法規的限制。在基因編輯技術的調控中還有很多問題需要解決。
病毒載體
病毒是一類可以有效感染人類細胞和其他動物細胞的微生物。病毒的能力是将其基因有效地導入宿主細胞,具有良好的基因遞送效率。是以,該病毒已被科學家轉化為基因治療的主要傳遞工具。基因治療中最廣泛使用的病毒載體包括逆轉錄病毒(病毒,RV)和慢病毒(LV),腺病毒(腺病毒,Adv)和腺相關病毒(腺相關病毒,AAV)等載體。
逆轉錄病毒載體是RNA病毒,但DNA互補鍊可以在受感染的細胞内轉錄,可以作為模闆合成第二條DNA鍊,可以摻入細胞基因組DNA中。病毒可以利用宿主細胞的酶進行自我轉錄和複制,RNA可以合成蛋白質,重新包裝病毒,RNA從細胞中釋放出來,成為傳染性病毒,載體可以以不同的方式改變。介導的過程允許病毒單拷貝基因組穩定地進入細胞。
慢病毒屬在分類上屬于逆轉錄病毒家族,包括8種能夠感染人類和脊椎動物的病毒,主要感染細胞以淋巴細胞和巨噬細胞為主,導緻個體感染的發作。慢病毒載體是單鍊RNA病毒,最常用的病毒系統是四質系統。與其他逆轉錄病毒相比,慢病毒載體具有容納更廣泛,分裂和非分裂細胞的感染能力,表達穩定并建構為攜帶約5kb和更長的靶基因的特征。
腺病毒是一種沒有細胞膜的線性雙鍊DNA病毒,目前分為5個屬。在臨床和科學研究中,主要使用Adv5腺病毒載體。腺病毒載體系統一般以人病毒為載體,以人體細胞為宿主,屬于非整合病毒載體,是以為人體蛋白質的準确翻譯和加工以及适當的折疊提供了理想的環境。腺病毒載體還具有宿主範圍廣、對人類緻病性低、增殖細胞和非增殖細胞中基因感染和表達、有效增殖癢高、不插入突變體、懸浮培養物擴增、同時表達多個基因等特點。
腺相關病毒是一類屬于微病毒家族的單鍊線性DNA缺陷病毒。腺相關病毒基因組DNA小于5kb,無包膜,形狀像暴露的20面顆粒。腺相關病毒載體具有安全性好、免疫原性低等優點,可感染分裂細胞和非分裂細胞,并能介導基因的長期穩定表達。是以,在神經系統的體内和體外研究中,腺相關病毒載體引起了很多關注。
目前,病毒載體仍然是臨床試驗中的主流載體。病媒的優點是轉染效率高,但缺點包括無法特異性群體,包裝能力有限,免疫原性強以及組織靶向性不足。其中,慢病毒宿主範圍廣,基因容量大,感染效率高,能将基因整合到宿主細胞中,實作長期穩定表達,常建構穩定菌株;
圖|病毒載體技術的比較
當然,還有許多其他類型的病毒載體,如牛痘病毒(牛痘病毒,VV),簡單孢子病毒(單純疱疹病毒,HSV),噬菌體載體等。以HSV病毒為例,HSV病毒滴度高,宿主範圍廣,外源基因容量大,對神經細胞具有特異性,但其毒性和免疫原性有待進一步驗證。是以,HSA病毒載體并未得到廣泛使用。
非病毒載體
非病毒載體的原理是利用合成載體材料的理化性質來介導基因轉移。與病毒載體相比,非病毒載體具有安全性高、包裝尺寸大、免疫原性弱、靶向性可控等優點,與病毒載體相比,非病毒載體成本更低、制備更簡單、大規模生産友善。在反義詞寡核苷酸和其他特殊外源基因片段的表達中,病毒載體具有傳統病毒載體不可替代的作用。
目前,所研究的非病毒載體主要包括脂質體、分子偶聯受體、聚合物(聚-L-賴氨酸、聚乙烯次胺等)、複合載體和納米顆粒載體。常用的基因轉移脂質包括陽離子、中性和陰離子脂質,其中陽離子脂質是研究最廣泛的,而基因轉移中使用的無機納米顆粒主要包括矽、碳納米管、氧化鐵等,它們主要通過細胞膜将藥物或生物分子輸送到生物體來治療疾病。雖然非病毒載體仍然存在轉染效率低等問題,但它們在基因治療領域發揮着越來越重要的作用。
圖|非病毒載體的特征
以脂質基、脂質樣非病毒載體為例。陽離子脂質和脂質樣載體可以通過靜電互相作用加載核酸。目前,這種非病毒載體microRNA、siRNA和shRNA遞送已得到廣泛應用。同樣,它們還可以提供基于質粒DNA、mRNA和RNP的CRISPR/Cas9系統。許多新結構和高性能脂質和脂質樣材料是為載體結構而設計的,這些載體通常需要PEG修飾。脂質載體通過PEG修飾實作長周期,通過被動靶向可以在惡性良性腫瘤組織中積累,其配體修飾或脂質結構修飾可以增強載體的靶向,促進細胞攝取,提高遞送效率。這種載體在屏蔽載體中正電荷,減少蛋白質吸附,其循環穩定性也可以提高,更能滿足人體給藥的要求。
圖|用于遞送CRISPR/Cas9體系的非病毒載體
聚合物聚合物是通過短鍊重複單元的聚合形成的。重複單元的高度可控的結構特性允許根據所含物質的響應性精确設計聚合物。結構多樣性和功能全面性使聚合物更有可能提供pDNA。
通常用于遞送蛋白質的納米載體包括膠體納米顆粒(例如脂質和固體脂質納米顆粒),聚合物納米材料(例如聚合物膜,納米膠囊和凝膠束),無機納米載體(例如碳納米管,量子點,介導管,磁性納米顆粒,金納米顆粒,金屬有機架構,黑磷納米晶片)等。磁性納米顆粒可用作磁共振成像的造影劑;金納米顆粒可以産生光熱效應;量子點粒子可以進行示蹤成像;一些納米顆粒可以同時攜帶藥物和基因。這些非病毒載體不僅有效地将基因藥物遞送到細胞中,而且還通過外部幹擾達到最佳的抗癌效果。
雖然非病毒載體的優勢顯而易見,但在CRISPR/Cas9體系中非病毒載體的遞送過程中仍存在許多問題,例如如何防止網狀内皮系統(RES)的鑒定和去除,如何在特定位置實作納米顆粒的富集,如何交叉由水磷脂細胞膜組成的水磷脂雙分子層, 等。
可溶性微針輔助基因治療,葡萄糖軟質類固醇藥物的遞送呈現新路徑
浙江大學藥學院教授袁平教授使用高特異性Cas9核糖核蛋白(RNP)基因編輯技術,通過給予具有有效上皮微針的糖皮質激素,以有效的方式有效治療發炎性皮膚病(ISD),标題為"微針輔助基因組編輯:靶向NLRP3的透皮政策"。CrispR-Cas9用于他們正在研究的協同作用,發表在科學子期刊《科學進展》(Science Advances)上。這項研究的結果使可溶性微針貼片基因編輯療法進入視野。
發炎性皮膚病(ISDs)是最持久的疾病之一,通常以産生促炎細胞因子來激活先天性和适應性免疫反應。牛皮癬和特定皮炎(AD)等發炎性皮膚病正變得越來越普遍,是公共衛生的主要威脅之一。目前,患者隻能從少量藥物中進行選擇,盡管糖皮質激素和免疫抑制劑是一線治療選擇,但大多數患者在長期治療後對糖皮質激素産生耐藥性,治療效果有限。是以,替代治療方案的開發是為對糖皮質激素産生耐藥性的患者提供醫療解決方案的重要突破。
大多數研究表明NLRP3激活與糖皮質激素耐藥性之間存在很強的相關性,盡管已經有許多關于幹擾NLRP3上遊相關因子激活以達到治療目的的小分子抑制劑的研究,但口服給藥後可到達下皮層的藥物量非常有限,不能達到有效的治療目的。是以,提高安全性和有效性已成為這一研發方向的重中之重。
Ping教授的團隊開發了含有針對NLRP3的Cas9核糖核蛋白(RNP)納米複合材料的可溶性微針(MN)貼片,以及含有Dex的納米複合材料。當粘在皮膚中時,微針可以迅速溶解并釋放兩個納米複合材料,然後被細胞和周圍的免疫細胞内化,有效地治療皮下發炎。微針通過皮膚輸送Cas9 RNP和Dex納米複合材料,破壞體外細胞NLRP3炎性胴體,并與Dex聯合有效治療特異性皮炎(AD)和牛皮癬。
當篩選sgRNA序列時,在CMAX(一種商業轉染試劑)介導的DC2.4和3T3細胞中編輯NLRP3基因位點,Indel效率高達35.4%和32.5%,并通過Sanger測序确認。此外,實驗發現,随着PLGA/Dex納米複合材料加入DC2.4細胞,NLRP3基因組位點的内嵌效率從29.6%提高到36.2%。在3T3電池中,Indel效率也從19.1%提高到31.7%。結果表明,Dex納米複合材料中的PLGA可以擴增細胞核孔,促進Cas9成核,并提高NLRP3基因位點的編輯活性。
通過微針介導的上皮治療政策的梯度遞送,基因編輯和葡萄糖皮質類固醇可以與治療的治療效果相結合, 最大化。該方法在發炎性皮膚病的治療中不僅具有巨大的潛力,而且為透皮給藥與基因編輯療法的結合提供了新的思路。
因為目前在非病毒載體基因治療領域的研究仍然大多在體外進行,體外結果存在一些差異。是以,未來非病毒載體基因治療的發展将更多地與體内研究相關。
目前市場上非病毒産品的代表
新血管原
俄羅斯人類幹細胞研究所于2012年推出的第一個非病毒基因治療産品由編碼内皮生長因子(VEGF-165)的質粒載體組成;和适應症:治療嚴重的肢體缺血。
鹵酸鹽
由Anges Japan推出,已于2019年被準許用于Nhs。Collategene由pVAX1-HGF組成,其表達HGF728作為人體内的異構體。其主要适應症是治療動脈粥樣硬化和血栓性血管炎。
Spinraza (Nusinersen)
由Biogen和Ionis Pharmaceuticals在美國聯合開發,将于2017年被FDA準許上市。它通過與SMN2基因轉錄形成的mRNA結合來改變RNA的剪接過程,進而增加正常SMN蛋白的表達。結果,該治療可以增加SMN1基因失活SMA患者SMN蛋白的正常LEVEL,進而維持運動神經元的存活。其主要适應症是兒童和成人的脊髓性肌肉萎縮症。
非病毒和病毒載體都為各種應用實施了CRISPR/Cas9遞送。基因治療也從基礎研究轉向藥物開發和工業生産。基因治療在血腫和罕見疾病的治療方面具有充足的市場空間,并在未來可用。随着研發水準和準備條件的提高,科研與臨床需求的結合以及轉化過程,未來在保險支付的支援下,基因治療終将有一天走進老百姓家。
<h1類""pgc-h-arrow-right-"資料跟蹤""148">關于地圖</h1>
資料地圖是集科技資料、智能分析、學術服務于一體,以科技未來本質為己任,提供研究資料庫、分析工具、學術會議、學術社群等功能,通過原創性研究的媒體傳播,有效擴大學術研究影響力的科技大資料平台。