關于 Dr.X:
Dr. X 是由晶泰科技博士團發起的專業知識分享欄目,旨在向生物醫藥行業傳遞和分享全球 AI 藥物研發的前沿技術與研發動态,促進廣大藥物研發從業者對 AI 藥物研發的認知,推動 AI 等前沿技術在藥物研發領域的應用。
合成緻死(Synthetic Lethality)這一概念最早由美國的遺傳科學家 Calvin Bridge 在 1922 年提出,并于 1946 年被 Theodore Dobzhansky 正式命名。簡單了解合成緻死,就是細胞中的兩個基因,任何一個單獨發生突變或者不發揮作用時,細胞均能成活;但兩者同時出現功能缺失時,就會導緻細胞死亡。近些年來,合成緻死在惡性良性腫瘤精準治療發揮着越來越重要的作用。
基于合成緻死的特殊機制,本文将通過幾個小問題,與大家共同探讨合成緻死在惡性良性腫瘤領域的應用與價值。
為什麼選擇合成緻死療法?
衆所周知,靶向藥物能夠特異性結合并作用于惡性良性腫瘤細胞的關鍵功能性蛋白,導緻其死亡,但迄今為止,可成藥的惡性良性腫瘤靶點相對較少。利用合成緻當機制,能夠間接靶向惡性良性腫瘤特異的突變,針對那些“不可成藥”的惡性良性腫瘤突變基因進行研究和開發。與此同時,針對靶向治療中新突變引起的耐藥問題,合成緻死療法也展現了一定的克服潛力。
合成緻死主要應用場景?
靶向 DNA 損傷修複(DNA damage repair, DDR)是目前“合成緻死”的主要實踐。多種内源性、外源性因素可不斷誘發 DNA 損傷,如堿基損傷、單鍊斷裂(SSBs)、雙鍊斷裂(DSBs)等,其中雙鍊斷裂對細胞的影響最為緻命。針對 DNA 損傷,細胞進化出了一系列 DNA 損傷修複通路,以保持基因的穩定性,包括同源重組修複通路(HRR)、非同源末端連接配接通路(NHEJ)、堿基切除修複(BER)、錯配修複通路(MMR)等。
DDR 通路之間存在互相依賴性,當 DNA 上某個基因突變導緻部分 DDR 元件功能損傷後,細胞的生存将依賴于其他 DDR 機制。此時如果找到該突變基因的配對基因,抑制其他 DDR 途徑,惡性良性腫瘤細胞 DNA 損傷将無法修複,繼而引導死亡。
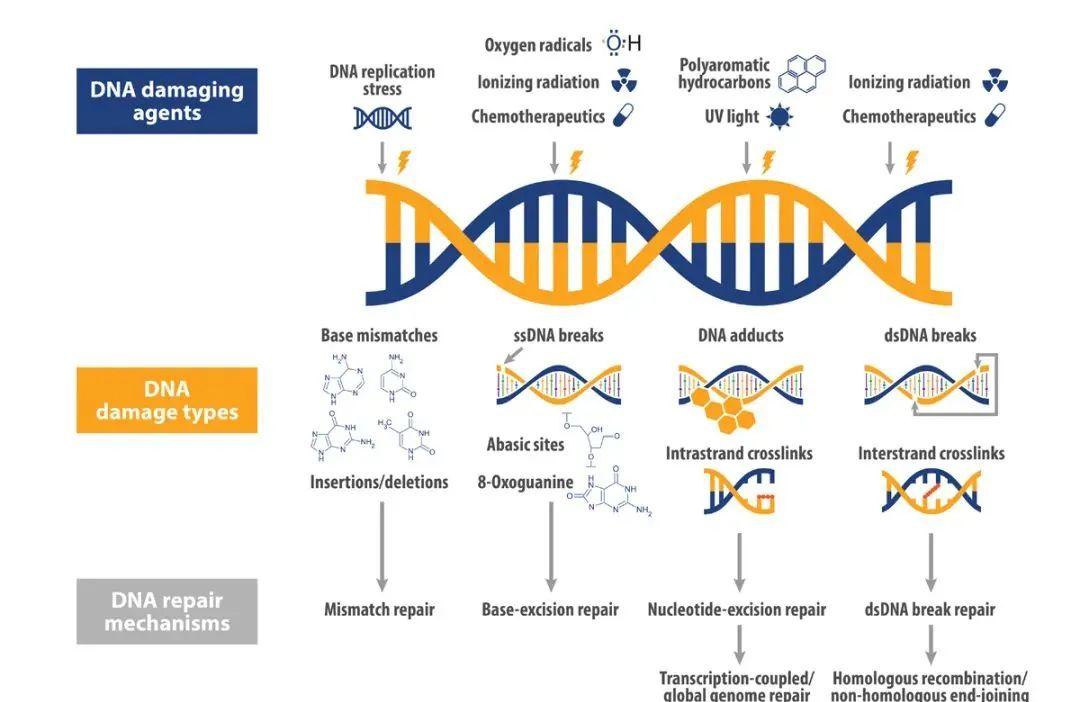
圖 1 DNA 損傷修複通路【1】
在研合成緻死基因對有哪些?
已上市合成緻死抑制劑:PARPi
目前最成功的且唯一經過上市驗證的合成緻死基因對就是 BRCA/PARP。BRCA1/2 基因發生突變的惡性良性腫瘤通常都存在同源重組缺陷(HRD),導緻細胞 DNA 雙鍊斷裂損傷修複(DSB)途徑缺陷;額外阻斷一個由 PARP 調控的 DDR 途徑,即堿基切除修複(BER),将導緻 DNA 損傷積累并達到關鍵數量,進而殺死細胞【2】。
圖 2 PARP 耐藥機制【3】
PARP 抑制劑已在卵巢癌、乳腺癌、前列腺癌等癌種上顯示了不俗的療效。例如在最近的 ASCO-GU 會議上,口頭報告了 PROpel 研究結果:奧拉帕利聯合阿比特龍較安慰劑聯合治療組,為 mCRPC 一線治療患者帶來了 8.2 個月的顯著 rPFS 獲益(24.8 個月 vs 16.6 個月;HR 0.66,95% CI 0.54-0.81;P < 0.0001),且無論 HRR 狀态如何。
圖 3 PROpel 主要研究終點 rPFS, 2022 ASCO-GU
後 PRAPi 時代,還有哪些潛在合成緻死靶點值得期待
PARPi 顯著的療效讓大家看到了合成緻死在惡性良性腫瘤領域的廣泛應用前景,但由于 BRCA1/2 功能恢複、非 BRCA1 依賴的 HR 恢複、恢複複制叉穩定性等原因【3】,耐藥問題也随之而來。抑制 DDR 代償通路、尋找新的合成緻死互相作用及精确靶标也是科學家進一步探索思考的點。
目前 PARPi 之外的合成緻死研究總體還處于探索階段,以臨床前和Ⅰ/Ⅱ期臨床試驗研究為主。通過分析目前研究的靶點,可以發現在合成緻死的研究主要有兩個方面:
一是尋找其他可配對的合成緻死靶點,期望找到下一個“PARPi”,這也是大家主要聚焦的方向。
以下是目前已發現的一些可能存在“合成緻死”關系的基因:
ATR 與 ATM:
ATR、ATM 是感覺 DNA 損傷的信号激酶,也是 DDR 的主要激活物。ATM 功能缺失後,癌細胞将依賴于ATR途徑;通過抑制 ATR 可達到殺死癌細胞的作用,這表明 ATR 和 ATM 之間存在合成緻死關系;另外,ATR 抑制可能被 DNA-PK 功能所代償。
WEE1 與 TP53:
WEE1 是絲氨酸/蘇氨酸蛋白激酶家族中的一員,可抑制 CDK 激酶的活性,進而抑制細胞進入有絲分裂;Wee1 和 P53 在某種程度上形成了一對合成緻死靶點。2021 年,AACR 年會上披露的資料驗證了 TP53 突變的惡性良性腫瘤對于 WEE1 抑制劑有一定的敏感性。
RAD51 與 AID:
RAD51 是一種高度保真的重組酶,參與維持基因的穩定性、DNA 損傷應答和細胞周期調節,在同源重組(HR)過程中扮演核心角色。2021 年 ASCO 的一項研究(摘要#3006)顯示,RAD51 抑制劑 CYT-0851 選擇性地誘導 AID 高表達惡性良性腫瘤細胞中損傷 DNA 蓄積。
PRMT5 與 MTAP:
作為經典的表觀遺傳學靶點,PRMT5 在“合成緻死”也展示出一定的潛力。PRMT5 敲除可選擇性殺傷 MTAP 删除惡性良性腫瘤細胞,而不影響正常細胞。
此外,還有 CHK1/2、DNA-PK、POLθ、USP1 等靶點也在研究中,因篇幅原因就不一一介紹了。
二是通過抑制其他代償性 DDR 通路,試圖解決 PARPi 耐藥問題。
在 2021 年的 ASCO 和 AACR 上均對這一方面的研究進行了報道。在 2021ASCO 大會上,Wee1 抑制劑(摘要#5505)、ATR 抑制劑(摘要#5516)均顯示出有克服PARP1/2 抑制劑耐藥的潛力;AACR 官方部落格也提到 POLθ 抑制劑和 ATR 抑制劑可能有助于克服 PARP 抑制劑的耐藥性【2】。
圖 4 基于 DNA 損傷修複的合成緻死靶點及在研藥物【4】
如何發現合成緻死基因配對?
PARP 抑制劑已經說明了合成緻死在惡性良性腫瘤治療領域的廣泛前景,其他合成緻死研究也在如火如荼進行中,但 DDR 信号通路非常複雜,如何尋找合适的合成緻死相關的基因突變是難點所在。
随着基因測序技術的發展與進步,基于 CRISPR 的表型篩選技術在發現新的藥物作用靶點中具有高通量、偏礙性小、準确度高的優勢。CRISPR 通過敲除惡性良性腫瘤細胞的特定基因,觀察惡性良性腫瘤細胞的生存狀态,進而找到潛在的緻死基因,加速了 PARP 之外的 DDR 抑制劑發展。與此同時,CRISPR 表型篩選與機器學習算法結合,可在複雜表型的聚類、特别是非監督機器學習對資料的降維和聚類處理,以發掘全新未知靶點和作用機制,獲得越來越多的共識【6】;劍橋大學的學者基于系統性 CRISPR 篩選開發了一個機器學習算法,用來精準篩查出對免疫治療更敏感的有錯配修複缺陷的惡性良性腫瘤【7】。
圖 5 CRISPR篩選實驗設計【5】
在拓展基于表型篩選的新機制、新靶點發現中,算法優化尤為重要。生物機體的複雜性決定了生物學資料的解讀無法被算法完全取代,是以開發更加人性化、易上手的算法,且注重人機(算法)協作,具有高度經驗卻不失客觀的高通量資料分析将是下一步優化的重點。
展 望
通過以上幾個小問題,我們大緻探讨了合成緻死的應用與價值,也看到了合成緻死在惡性良性腫瘤治療領域的廣闊空間。相比于傳統化療和放療,合成緻死這一療法還很“年輕“,還有很多問題需要社會各界共同探讨和解決,例如如何進一步明确 DDR 信号通路間的互相依賴作用、DDR 之外有哪些合成緻死新可能、如何更有效地解決 PARPi 耐藥等。相信在未來,随着技術的發展和研究者的不斷鑽研,以及機器學習等前沿技術的賦能,合成緻死療法将迎來一個個突破,為患者提供更有效精準的治療方案。
參考文獻:
[1] https://blog.crownbio.com/dna-damage-response#_
[2]https://www.aacr.org/blog/2021/12/06/molecular-targets-2021-examining-synthetic-lethality-beyond-parp-inhibitors/
[3] Dias MP, et al. Nat Rev Clin Oncol. 2021; doi:10.1038/s41571-021-00532-x
[4] P. Pilié, Nat Rev Clin Oncol. 2019
[5] Bock, et al. Nat Rev Methods Primers 2, 8 (2022). https://doi.org/10.1038/s43586-021-00093-4
[6]https://www.drugtargetreview.com/article/44422/phenotypic-profiling-in-drug-discovery/
[7] Zou, X.,et al. Nat Cancer 2, 643–657 (2021). https://doi.org/10.1038/s43018-021-00200-0
本文僅供學術交流,圖源網絡,侵删
關于晶泰科技
晶泰科技是一家量子實體與人工智能賦能的藥物研發公司,通過提高藥物研發的速度、規模、創新性和成功率,緻力于實作藥物研發的行業革新。作為一家立足中美、服務全球的企業,晶泰科技始終堅持探索最優解決方案,以充分利用前沿的研發與計算資源,最大化滿足客戶與合作方的需求。
晶泰科技的智能藥物研發平台将基于雲端超算數字化研發工具與先進的實驗能力進行整合,形成高精度預測與針對性實驗互相印證、互相指導的研發系統。作為全球先鋒人工智能藥物研發公司之一,晶泰科技已建立起一整套量子實體幹實驗室與先進濕實驗室緊密結合的研發疊代流程,挑戰傳統研發的效率瓶頸,賦能新藥研發實作創新速度與規模的突破。
業務/活動咨詢請聯系:[email protected]