β-内酰胺类药物(β-内酰胺类药物)是指一大类抗生素中含有β-内酰胺环的结构,按母核结构的差异可分为青霉素、头孢菌素、碳青霉素和单环β内酰胺等主要类,其中青霉素类药物和头孢菌素类药物在兽医临床应用中最为广泛。本部分总结了β端酰胺类药物的结构和分类、理化性质、药理学研究、毒理学研究、国内外限量要求,以及残留物检测样品预处理、仪器测定方法等,以期为全面了解此类药物和残留物检测提供参考。
1 结构和分类
1.1 结构
β-内酰胺型药物结构含有β-内酰胺母核四环结构,这在天然产物中很少见,是此类抗生素的代表性特征。青霉素和头孢菌素是使用最广泛的,其结构特征如图5-39所示。
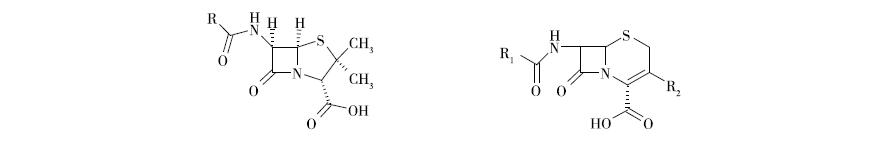
(1)基本结构由母芯和侧链组成。母核包含一个四元β端酰胺环,其通过氮原子及其相邻的三个碳原子,随着第二个五环或六环变厚。青霉素的增稠环为盐酸盐环,母核结构为6-氨基青霉素酸(6-氨基青霉素酸,6-APA);
(2)C6或C7位含有基于芳酰胺的侧链(RCONH-),它通常是侧链的连接点。
(3)母核结构有2个不共沸的致密环,青霉素类沿N1-C5轴折叠,头孢菌素类沿N1-C6轴折叠。
(4)青霉素样细胞核含有3个奇麦尔碳原子,8个旋转异构体只有2S、5R、6R活性的绝对构型,因此完全合成非常困难;
普通β内酰胺类药物的化学结构如表5-28所示。
1.2 分类
1.2.1 青霉素类药物的分类
青霉素药物分为天然青霉素和半合成青霉素,从微生物发酵液中提取的天然青霉素,包括青霉素F、青霉素G、青霉素X、青霉素K和双氢青霉素F5成分,其中青霉素G含量最高,疗效最好;
根据青霉素类药物的抗菌谱,分为五大类,第一类主要用于抗非产β酰胺酶革兰氏阳性菌,包括葡萄球菌、链球菌、孢子菌等引起的感染,属于窄谱青霉素,代表抗生素有青霉素G(注射)钠钾盐、青霉素V(口服)、青霉素、青霉素等;第三类是耐青霉素的青霉素,对青霉素酶稳定,主要用于各种抗生产酶引起的葡萄球菌感染,其抗菌谱窄,代表抗生素如毒死蜱、二毒死蜱、苯二氮卓类、氟毒死蜱等;假单胞菌的活性广谱青霉素,代表吡啶、四辛、吡拉西林、阿洛西林、美洛西林等抗生素,第五类是青霉素,主要作用于革兰氏阴性菌,对大肠杆菌只有良好的作用。抗菌谱窄,代表抗生素如蟒蛇、蟒蛇、他莫西林等。
1.2.1 头孢菌素类药物的分类
头孢菌素类药物均为半合成药物,主要合成方法是在母核结构中引入R1、R2位的不同侧链基团,按合成时间顺序可将头孢菌素类药物分为四代。第一代头孢菌素对青霉素酶稳定,但对大多数革兰氏阴性菌的耐药性较差,β,包括头孢菌素、头孢菌素、头孢菌素和头孢菌素等药物。第二代头孢菌素,包括头孢菌素、头孢菌素等,已经生产出相对较少的药物,近年来逐渐在医学临床上得到应用,但在动物临床应用中却很少。第三代头孢菌素含有较多的种类,临床常用药物有头孢菌素、头孢菌素、头孢菌素、头孢菌素等,这些药对β-cylamide酶、厌氧菌和革兰氏阴性菌均有显著作用。第四代头孢菌素具有广谱、高效、β-endamide酶的高度稳定性,主要用于治疗持续性传染病,包括头孢菌素、头孢菌素等。其中,第三代头孢菌素和第四代头孢菌素都是动物专用药物,效果确有。
2 物理和化学性质
β-内酰胺类药物在水中和油性有机溶剂中的溶解性较差,因此临床药物多为钾盐或钠盐,盐类可溶于水、乙炔、甲醇和乙醇等极性溶剂,外观为白色结晶或粉末状,无味或有异味,具有不同程度的吸湿性。β酰胺类药物多为旋风,青霉素型药物缺乏紫外线吸收性能,其紫外线吸收通常来自苯环的侧链,特性不强;
青霉素类药物和头孢菌素在药物结构中含有羧基,属于有机酸,其pKa一般为25~28,表现出较强的酸度,而母环具有可质子化的萼胺位点,因此分子一般表现出一些性别化合物的特征。β-内酰胺环是药物结构中最不稳定的部分,当与碱、酸、重金属(氧化剂)和酶相互作用时,会发生水解反应和分子重整,导致药物失效。目前,关于青霉素G降解反应的研究和报道较多,青霉素G能稳定在干燥状态,在水溶液中易代谢,酸能产生二酸青霉素、青霉素等β-国产酰胺药物残留,碱、醇或酶可产生青霉素和青霉素等物质。其中,青霉素可以聚合成青霉素聚合物,可以与肽或蛋白质结合形成快速的毛发过敏原,青霉素G是人体过敏反应的主要原因。
3 作用机制
Β-内酰胺类药物具有相似的作用机制,通过抑制细胞壁粘膜肽合酶的产生,干扰细胞壁肽多糖的合成,使细菌细胞壁断裂,细菌扩张破裂死亡。β内酰胺类药物通过抑制肽聚糖转肽酶来抑制细菌细胞壁的合成。棒状肽是细菌细胞壁的主要成分,是一些网状结构的含糖多肽,是由N-乙酰谷氨酰胺和N-乙酰基壁氨基酸交替组成,由线性多糖链肽组成,这些聚合物需要通过粘膜肽催化的跨肽酶转肽反应,使线性聚合物转化交易结构, 完成细胞壁的合成。β内酰胺类药物用于抑制粘膜肽转肽酶的活性。由于其结构与粘膜肽-D-丙氨酸的末端结构相似,组成相似,使得酶鉴定错误。青霉素与酶的活性中枢共价性竞争性结合,形成不可逆的抑制作用。由于缺乏酶催化,短肽不能转化为链状结构,细胞壁不能合成。无细胞壁,细胞不能成形并受到细胞内高渗透压力,导致裂解酶和细菌死亡。这一特点有很大的优点,因为人体细胞没有细胞壁,药物对人体细胞不起作用,有很大的选择,所以β内酰胺类药物都是毒性很大的抗生素。
细胞壁粘膜肽合酶是青霉素结合蛋白(青霉素结合蛋白、PBPs),近年来研究人员证实,细菌细胞膜上的特殊蛋白PBPs是β-endamide药物的靶标,PBPs的数量不同,细菌细胞膜上的相对分子量、对药物的敏感性,此外,有报道称,这类药物还可以引发细菌自解活性,对细菌有致死作用。
青霉素和头孢菌素类药物种类多,抗菌谱范围广,在兽医临床上广泛应用由葡萄球菌、链球菌、肺炎球菌、大肠杆菌、沙门氏菌、嗜血杆菌等细菌引起的各类动物传染病。
4 药理学研究
4.1 药物的吸收和分配
β酰胺内药物化学不稳定,易受胃酸和β-endamide酶的影响,除青霉素V、阿莫西林等耐酸小部位外,该药物可口服,大多数β-endamide药物通过肌内注射、皮下注射或静脉注射。一般认为,大多数β端酰胺类药物的吸收位点在胃肠道内,但体内不同药物的吸收机制存在显著差异,Bretschneider等人认为,吸收机制的差异可能与药物本身的前列腺和肠道转运蛋白的差异有关,他在跨膜转运过程的Caco-2细胞单层模型中研究了23种β内酰胺药物, 肽转运蛋白Peptransporter1被发现是头孢菌素羟基孢菌素,头孢菌素,头孢菌素,头孢菌素,氨苄西林等药物的良好转运蛋白,但对头孢菌素等药物没有亲和力。此外,肠道中的pH差异对药物的吸收有影响,一般认为哺乳动物肠道中β内酰胺类药物的最佳pH吸收环境为61~68。
β内酰胺类药物在体内分布广泛,肝脏、肾脏和肺部浓度最高,仅次于皮脂和肌肉,脑脊液和乳汁中也是如此。组织炎症和给药方式的差异可导致药物在体内的异常分布,如母乳在乳腺炎治疗期间母乳 pH 值升高,血浆乳屏障受损,β端酰胺型药物易电离乳房灌注是将治疗药物直接注射到的感染部位, 这些特点导致治疗药物被乳房严重吸收,并且随着哺乳和吸收的增加,有报道称青霉素G在通过乳房灌注治疗乳腺炎时,24h母乳中给予的药物量可达到注射的42.6%。
4.2 药物的转化和排泄
β内酰胺类药物在动物中的半衰期较短,哺乳动物之间的差异较小。牛阿莫西林在奶牛中的消除半衰期为1.5h,狗和猫为0.75~1.5h,氨苄西林在狗和猫中的消除半衰期为0.75~1.3h,猪为1.0h;牛、马、牦牛、猪和兔肌内注射的半衰期分别为1.02h、2.6h、1.63h、2.56h和0.52h,牛、马、骆驼、猪、羊静脉注射,狗和火鸡的半衰期分别为1.2h、0.9h、0.8h、0.7h、0.7h、0.5h和0.5h。杨大伟等研究了猪头孢菌的药代动力学过程,肌内注射后吸收迅速,达到0.28~0.52h的血药浓度峰值,消除半衰期1.79~2.77h,结果与奶牛药理学研究结果进行比较,牛头孢菌素注射液的消除半衰期为0.3h, 药理排泄过程的差异不明显。
β-国产酰胺类药物进入血液循环,在体内不易被破坏,主要由原型从尿液排泄,梁伟等21种常用β-国产酰胺类药物排泄途径,苯二氮卓类、头孢菌素等主要药物原型通过肾脏排泄,肾功能下降时半衰期相应延长,吡嗪、头孢菌素等药物除由肾脏排泄, 原型的一小部分由肝脏和胆汁系统排泄,并通过胆汁排出到肠道后重新吸收到血液中,形成肝脏和肠道循环。此外,不同的给药方法和部分药物都会对药物的排泄方式产生影响,吡哆醇在治疗牛乳腺炎时,口服给药主要通过肾脏和胆汁排泄,但乳房灌注给药的量大部分是用母乳排出的。FDA调查显示,不注意安全用药时间是牛奶中兽药残留的主要原因,牛奶中61%的兽药残留是奶牛哺乳期药物治疗造成的,31%来自牛奶干乳药物治疗。不同的给药途径可导致牛奶中药物残留的时间不同。当青霉素G治疗奶牛乳腺炎时,在肌肉中以相同剂量和给药时间施用的奶牛的牛奶中检测到青霉素G的残留物,而在通过乳房灌注给药的奶牛中,通过哺乳排泄青霉素G的时间为144h。此外,药物在牛乳腺组织中的停留时间也存在差异。在相同给药方法的情况下,头孢菌素与牛奶的排出时间为52h,头孢菌素与乳汁的排出时间为84h,与氯霉素相邻的乳汁排出时间为96h。
5 毒理学研究
β内酰胺类药物本身通常毒性低,但含有蛋白质的化合物可能是非常强的过敏性来源,导致严重的过敏反应———过敏反应。
青霉素类药物在体内的主要不良反应是过敏反应发生率高,在各类药物中排名第一。据世卫组织统计,青霉素药物过敏反应发生率为07%~10%。青霉素过敏反应包括快速头发过敏反应和晚期头发过敏反应,原临床表现为过敏性休克、荨麻疹、血管性神经水肿等,是I型介导的超敏反应;其中,过敏性休克最为严重,可在短时间内致命。
根据Dewndycetal的说法,过敏反应是由预先形成的过敏原引起的,例如青霉素 - 蛋白质结合,它们留在动物体内。根据现代免疫学理论,由于过敏原必须具有特定的抗原来确定簇和多价等必要条件,目前临床应用的青霉素药物相对于分子量小于1000,因此不具有免疫原性,而是通过与蛋白质、肽、多糖等大分子载体的组合形成完整的抗原或自聚合成多价半抗原, 成为过敏反应的主要原因之一。此外,Brander的研究发现,青霉素直接与T淋巴细胞表面的组织相容性复合物(MHC)肽复合物分子结合,刺激T淋巴细胞的增殖并诱导进一步的反应,而无需抗原呈递细胞呈递C.张建民等人研究了在8860例有过敏史的医院病例中的药物使用情况, 并发现β端胺类药物过敏比例最大,青霉素类药物过敏反应率最高,占总比例的37.8%,头孢菌素类药物过敏反应发生率为11.3%。在单一药物的情况下,青霉素G的过敏反应发生率最高,占青霉素类药物过敏率的89.4%。
6 国内外有限要求
为了保护消费者的健康和安全,中国、欧盟、美国等国相继开发了β内酰胺类药物在动物组织中的OFR,表5-29为我国,欧盟关于动物组织中β内酰胺类药物MRL的规定。
7 检测方法
7.1 样品预处理
样品的预处理主要包括提取、纯化、浓缩(富集)、衍生化等过程,占检测分析过程总量的近70%。与其他药物相比,β端酰胺类药物化学不稳定,易受试剂、温度等预处理因素的影响,且样品中药物残留浓度低,因此样品预处理技术对β端酰胺药物的分析和检测具有重要意义。
7.1.1 样品提取
7.1.1.1 提取的液体
提取物的作用是从样品中提取靶标,在保证目标物质提取效率的前提下,需要考虑基质的干扰。β-家酰胺类药物大多通过药物原型留在动物组织中,母体结构中含有氩碱和质子可碱的脓毒症部位,表现出两性、中极性或极性化合物的一些特征,可溶于极性有机溶剂和酸性或碱性水溶液。因此,可根据药物的性质选择合适的提取物,目前常用β-endamide药物残留分析的提取溶剂有乙炔、乙炔酸、酸化甲醇、乙炔二氯甲烷、磷酸盐缓冲液和钨钠。生物样品中常用的提取溶剂β酰胺药物残留物可分为无机试剂提取物和有机试剂提取物。
7.1.1.1.1 无机试剂提取物
β-内酰胺类药物可溶于酸性或碱性水溶液,残留分析中选取的无机试剂多为稀酸、缓冲液等。刘伟等动物组织从鸡肉、猪肉、猪皮、猪油、猪油等中提取磷脂缓冲液,经HPLC检测,药物回收率为70.9%~86.8%。优科等选用钨酸钠作为提取溶剂,从牛的肾脏和肝脏中提取7种青霉素药物,经LC-MS/MS提取试验后,药物的回收率高于66%。黄百芬等20%醋酸铅溶液在牛奶中12种青霉素药物和7种头孢菌素药物进行提取,样品沉淀后用HLB固相提取柱纯化,用UPLC-MS/MS检测,19种药物的定量限值可达0.034μg/L,回收率为73.4%~112.7%。
7.1.1.1.2 有机试剂提取物
β-赖酰胺药物残留分析广泛用于甲醇、乙炔、丙酮、二氯甲烷、三氯甲烷等有机溶剂作为萃取剂,这些溶剂具有良好的溶剂作用和渗透能力、提取速度快、脱蛋白脱脂等优点,目前使用的提取试剂较多。甲醇易使β-endamide药物醇化,影响药物回收,且甲醇提取物杂质较高,目前使用较少。酸性有机溶液有利于提高一些β端酰胺药物的回收率,但由于大多数药物β端酰胺环不稳定性,在酸性溶液中易降解,因此酸性有机溶液只能用于提取一些稳定的药物。为了增加萃取器的选择性,必要时使用混合溶剂,如三氯生甲醇、二氯甲烷-乙炔、乙炔-水等。以神鹰兵等含有25%高氯酸的乙炔溶液为提取剂,从人血浆中提取头孢菌素,经HPCE检测,回收率为97.6%~104.5%。DeAlwis等选用甲醇-三氯生酸在酒中对青霉素、氨苄西林等各类抗生素进行提取,药物回收率为50%~100%。从生物组织中提取的Mieke等β-裂解药物如氨苄西林、阿莫西林、头孢菌素、头孢菌素、美洛宾等增加了提取药物的种类,但回收率略低(59.9%~71.5%)。Cmara β-莱纳米类如氨苄西林、青霉素G、青霉素V、头孢菌素、二毒死灵、毒死蜱、苯二氮卓类、头孢菌素、头孢菌素等在羊奶中用乙炔、5mL羊奶加5mL乙炔提取药物,节省了提取试剂的用量,但提取器的沉淀效果不好,在用SPE柱纯化前,膜过滤需要0.45m。此外,EDTA、磷酸盐缓冲液等也可用于β-内酰胺型药物,DeAlwis尝试使用三氯生-EDTA提取青霉素G、氨苄西林2种药物,药物的回收率为50%~100.0%。桑托斯等人用20%的三氯生乙酸溶液在牛奶中提取了阿莫西林等6种药物,回收率超过72%。以李牧等乙炔为提取剂,从血液和尿液中提取多种头孢菌素药物残留物,经HPLC检测,回收率高于80%。
为了进一步提高生物样品中β端酰胺药物残留的提取效率,许多研究人员还选择了不同的物理或化学提取技术,常用的提取技术有均质提取、振荡提取、超声辅助提取等。前两种提取方法是常规技术,而超声波辅助提取主要利用超声波的机械效应、空心效应和热效应,通过增加介质分子的运动速度和穿透力来提取待测组分。操作时将适量的生物样品与提取溶剂混合,借助超声波水浴作用一段时间,选择合适的超声波强度和超声波时间达到定量提取的目的,这个过程是一个物理过程,在整个提取过程中不会发生化学反应, 不影响大多数药物活性成分的生理活性,操作简单,可一次提取多个样品。张伟等9种牛奶β-endamide药物残留检测,选用乙炔和磷酸盐缓冲液进行提取,20kHz超声辅助提取5min,纯化用HPLC检测,所有药物回收率达71.0%以上。
7.1.2 样品的纯化
由于样品基质性质复杂,一些性质上与待测组分相似的常见提取物被提取在一起,这些杂质往往会干扰光谱检测,增加基线噪声,降低色谱效率,堵塞色谱线,污染柱和检测器等,因此在色谱和其他检测之前纯化操作是必不可少的。纯化处理方法主要包括液-液萃取(LLE)和固相萃取(SPE)两大类。
7.1.2.1 域名注册
LLE是一种传统的纯化方法,试验条件不高,是纯化β-endamide药物残留的基本方法。该方法在不同溶液中使用不同溶解度的不同物质,使阿德勒从一相到另一相,从而实现样品的纯化。二氯甲烷和三氯甲烷通常用作液液分布溶剂,有时加入氯化钠以增强溶剂的离子强度,进一步提高β-lyceramide药物在有机相中的转移效率。此外,从样品基质中提取后,通常使用非极性溶剂如正己烷和醚进行脱脂。Jank等人建立了基于LLE和LC-MS/MS组合的快速检测牛奶中β端酰胺药物残留的方法,并用乙炔提取牛奶中的药物,回收率均超过60%,测试限值符合欧盟标准。
Kukusamude等人还利用十六烷基三甲基溴(CTAB)、TritonX-114等建立了混合胶束的浊度提取方法,并对不同pH值、CTAB、提取时间、Triton浓度、盐浓度等的浓度进行了详细的研究(图5-40)。
LLE是一种经典的纯化方法,试验条件不高,但需要大量的高纯度溶剂,提取时间长,回收率不理想。为了提高提取效率,可以同时使用加压液体提取和超临界流体提取等辅助提取技术。
从牛奶青霉素G、毒死蜱、苯二氮卓类等三种药物残留中提取出四丁基溴铵作为离子还原试剂的药物,系统分析了不同pH值、不同四丁基溴浓度、不同盐浓度对离子提取对试剂提取的影响,直接对液液萃取后的上层溶液进行LC-PDA检测。康德尼等人通过"加压液萃取"和固相萃取法测定了6种β端酰胺类药物在动物饲料中的残留量,并系统研究了影响加压溶剂提取的因素,如溶液成分、温度、容器尺寸、萃取循环次数、溶液体积等;从14个市场采集的样本均采用这种方法进行了测试。
7.1.2.2 SPE
SPE是在LLE的基础上开发的一种新型纯化技术,是样品预处理的主流纯化技术,其原理是利用固体吸附剂吸附目标化合物在液体样品中,使其与样品底物和干扰素分离,然后用溶液洗脱或热解吸, 达到目标化合物的分离富集目的,目前被广泛用作样品的纯化方法。SPE可纯化小体积样品,溶剂用量小,选择性高,可根据不同受试者选择不同的填料,按固定机构可分为正向固定相、反向固定相和离子交换固定相等。主要包括C18色谱柱、混合离子色谱柱(OasisMAX、CleanertPAX)、亲阳离子色谱柱(ProElutSAX)、亲水色谱柱(OasisHLB)等。
β-国产酰胺类药物结构中含有碳蛋白、氨基,通常是极性的,所以这类药物可以选择倒置萃取柱,如C18柱和HLB柱等,β-endamide药物属于有机酸,根据目标物质的化学性质酸度,有些药物可以选择混合阴离子柱。SPE色谱柱的选择需要根据被测药物的类型和性质进行测试和筛选。对马卡罗夫等动物肌肉组织中8种β端酰胺药物残留进行了测试,比较了HLB柱、C18柱、MAX柱、ENV柱的纯化效果,试验结果表明,Enrvy柱的纯化效果最好,MAX柱的回收率最低,而C18柱保留了最高的阿莫西林储量, 氨苄西林和青霉素G,但相邻氯霉素的回收率明显低于其他提取柱,HLB柱明显优于MAX柱。但仍低于其他两个萃取柱,此外,实验研究了pH值对4个萃取柱保留能力的影响,发现当pH值为5~9时,SPE柱更适合β-endamide药物。Fernandez-Torres等人比较了C18色谱柱和Plexa固相萃取柱对包括β-lyamide药物在内的4类药物的纯化效果,并详细比较了不同pH值、不同洗涤洗脱液的纯化效果,结果表明Plexa固相萃取柱优于C18柱。郭德华等已建立兽源食品76种兽药残留SPE,样品采用乙炔和镁离子柠檬酸缓冲液进行提取,除去有机相以缓冲液重溶,聚合物和阳离子交换SPE柱系列纯化,用甲醇和甲醇氨(95:5)逐步洗脱,用LC-MS/MS测定,用法定量的底物曲线, 回收率为59.4%~115.3%,RSD为2.6%~27.3%,该方法在市场上成功用于筛选样品。张琦与阿莫西林、头孢菌素、氨苄西林和青霉素V等标准混合物的HLB柱、C18柱、MAX柱的纯化效果进行了对比,结果表明,HLB柱对被测药物的保留能力最好,4种药物的回收率均高于70%。在多残留分析中,药物的性质存在差异,除了选择SPE柱的适当保留机制外,为了最大限度地提高SPE柱的保留和纯化能力,有必要对SPE柱的纯化条件进行测试和筛选。
7.1.2.3 基质固相分散(MSPD)
MSPD是一种类似于SPE的纯化技术。Barker等人于1989年首次提出这一技术,使试样与硅胶反向粘结结合均匀后,研磨、柱,然后选择合适的洗涤柱,将目标化合物洗脱下来。该方法纯化效率高,耗时省溶剂,但实现自动化并不容易。王莲等人建立了针对畜肉和牛奶中20种兽药残留的MSPD纯化方法,将生物样品与C18填料混合均匀,填充到SPE空气管中压实,置于SPE装置上,用甲醇减压洗脱,洗脱液用40氮气吹干,用乙炔-乙酸铵溶解(2∶8, V/V),滤膜样品,药物检测限为0.05~3.05g/kg,回收率70%以上。
7.1.2.4 QuEChERS方法
QuEChERS法是近年来发展起来的用于农产品快速检测的样品预处理技术。该方法具有回收率高、结果准确、样品处理量大等优点,减少了试剂的消耗以及试验人员与有毒溶剂的接触,能有效地结合萃取、分配和纯化,进一步降低萃取步骤,提高萃取效率。QuEChERS法通常主要体现在分散固相萃取中,Pérez-Burgos等建立了检测7种头孢菌素药物残留的方法,QuEChERS法,牛肉样品通过15mL甲醇水溶液(8∶2,V/V)振荡提取离心后,将10mL液体加入到150mgC18和900mg硫酸镁中不加水, 振荡5min,离心取5mL液体,用氮气吹干,LC-MS/MS检测后可溶,该方法的定量限为4~50μg/kg,RSD小于15%。Karageorgou等人使用超声辅助MSPD建立了quEChERS方法,用于检测牛奶中12种内酰胺类药物的残留物。
分子印迹技术
分子印迹技术使用分子印迹聚合物(MIP)作为固定相,对目标分子具有特定的识别能力。王辉等合成青霉素特异性吸附能力的青霉素特异性印迹聚合物PenG-MIP,MIP用于检测牛奶中的青霉素,实现分子印迹技术对牛奶中青霉素残留物的快速定量检测,检测限为5 sg/L,精度高,操作方便,且PenG-MIP颗粒可反复使用,大大降低了检测成本。
7.1.2.6 免疫亲和色谱(IAC)
IAC是一种基于抗原抗体特异性、可逆免疫结合反应的色谱技术。在纯化过程中采用抗体连接的惰性基质固定相,特异性好,选择性高,是生物样品的有效纯化方法之一。Zhi等人建立了自动流动电流免疫测定系统,定量测定了牛奶中头孢菌素的残留量,检测限为1 μg/L,定量限为3 μg/L,均低于欧盟标准规定的牛奶中头孢菌素的MRL。该方法对头孢菌素选择性高,其他头孢菌素和青霉素类药物对其检测干扰小,适用于牛奶中头孢菌素残留的定性和定量分析。IAC特异性好,选择性强,在药物分析中具有广阔的前景,但由于免疫方法的局限性,应用不广泛。
7.2 检测方法
国内外已有多篇关于β端酰胺药物残留检测技术的报道。目前,用于检测β酰胺药物残留的方法有高效液相色谱(HPLC)、毛细管电泳(CE)、液相色谱-质谱(LC-MS)、气相色谱(GC)、免疫测定、微生物学等。
7.2.1 气相色谱
GC是以气体为流动相的色谱工艺,适用于气体,沸点低,物质易汽化,而β酰胺药物本身不易汽化,需要在预处理过程中衍生出来。Meetschen等人利用GC测定了7种β-endamide药物在动物组织中的残留,并用重氮甲烷衍生出它们以形成挥发性青霉素甲酯,回收率为46.0%~73.0%。GC要求样品能够汽化,受样品挥发性约束,大多β端酰胺药物挥发性和热不稳定性,虽然可以使用一些预处理方法,但操作难度增加,工艺复杂,并且改变了样品的原始形式,不易回收,因此在-endamide药物残留分析中,GC已基本被LC取代。
7.2.2 高效液相色谱
HPLC是分析β酰胺中药物残留最常用的技术之一,常见的检测器包括紫外线检测器(UVD),荧光检测器(FLD)和二极管阵列检测器(DAD)。
由于青霉素药物没有单一的紫外发射基团,其吸收波长一般为200~235nm,且该波长范围内的选择性较小。由于青霉素药物在生物样品中的残留量低,背景干扰往往较严重,因此一般采用柱前或柱后导联技术,衍生反应可有效提高UVD的灵敏度。如果青霉素是在米喹或 1 , 2 , 3 - 曲安奈酮的催化作用下形成的,则最长为 325nm ,在检测波长处共生成分干扰测定很少,并且该方法针对β端酰胺环的化合物,利用这一原理, Bioson 、 Verdon 等都建立了检测青霉素药物残留的检测方法。[0005] 蔡玉轩等人采用HPLC-UVD方法检测头孢菌素、头孢菌素、头孢菌素、头孢菌素5种头孢菌素药物残留物,以磷酸缓冲液-乙炔为流动相,在270nm处,检测限小于9.7 sg/kg,回收率为96.5%~105.0%。DAD属于UVD的一种类型,其原理与UVD相同,可以在全波长下扫描,可用于混合不同波长的物质的检测。Cmara等人利用DAD建立HPLC检测羊乳中阿莫西林、青霉素G、青霉素V、阿莫西林、二氯西林、毒死蜱、苯基苯西林、头孢菌素、头孢菌素9 β-endamide药物的残留物,回收率为79.0%~96.0%。在药物多残留分析中,为了达到理想的检测结果,HPLC可以串联不同的检测器,贝尼托-佩纳等建立了青霉素G、青霉素V、吡哆醇、苯二氮卓类、毒死蜱、二氯硅烷、阿莫西林8种HPLC-UVD/DAD检测方法,用于残留β内酰胺药物,选择220nm进行检测波长,检测限为8.0~24.0μg/kg, 平均回收率为82.0%~97.0%。
FLD比UVD具有更强的敏感性和特异性,但要求药物具有荧光特性,这比单一或少数药物的准确检测具有一些优势。由于β内酰胺类药物没有荧光发射基团,因此有必要使用衍生物来产生荧光染发基团。罗道等建立了牛奶氨苄西林残留HPLC-FLD检测方法,采用甲醛法制得药物,激发波长和发射波长分别为346nm和420nm,检测限为1.0μg/kg,回收率为70.0%~110.0%。Terada等人利用氨苄西林可以在甲醛和三氯生溶液中产生荧光衍生物的原理,并利用FLD测定氨苄西林在牛奶中的残留量。
7.2.3 液相色谱
LC-MS是一种现代分析技术,以LC为分离手段,MS为检测器。LC-MS结合了LC和MS的优点,将LC对复杂样品的高分离能力与MS的高选择性和灵敏度相结合,特别是串联质谱(MS/MS)能够提供更详细的相对分子质量和结构信息,使这种组合技术广泛应用于药物分析、食品分析和环境分析等诸多领域。
由于ms/MS的研究与开发,LC-MS/MS在β内酰胺类药物多残留检测领域取得了长足的进步。Ohmori等选择LC-MS/MS检测了8种β-endamide药物在血浆中的残留量,检出限为0.01~0.5 μg/mL,除多利哌宁外,美罗培南回收率为49.1%、62.3%,其他药物的回收率均在80.2%以上。马卡罗夫等人建立了八种青霉素类药物在牛、猪、鸡组织中如阿莫西林、氨苄西林、二氯吡啶、青霉素G、青霉素V、苯二氮卓类、毒死蜱和吡哆醇LC-MS/MS的检测方法,其内标的法定用量,除阿莫西林回收率仅为50.0%外,其他药物的回收率均在70.0%以上,所有药物检测限值均低于或等于欧盟规定的MRL。Becker等人采用LC-MS/MS方法测定牛奶、阿莫西林、氨苄西林、头孢菌素、头孢菌素、头孢菌素等组织中15种β-裂解酰胺类药物的残留,采用ESI-plus检测,头孢菌素、青霉素G、青霉素V、苯二氮卓类、鲈鱼毒死蜱、二毒死蜱和吡哆醇等,使用ESI检测,使用基质加成校正基质效应,但氨黄素除外,其回收率仅为57.0%, 其他靶标测定的回收率大于81.0%,所有药物检测限值均符合欧盟标准。Lina等人建立了11种Β端酰胺药物残留的LC-MS/MS方法,以0.1%醋酸溶液-0.1%甲醇为流动相,30min内分离出18种药物,平均回收率为71.0%~115.0%,检出限为0.12~3.94 μg/kg。
Carlier等人采用超高效液相色谱(UPLC)代替HPLC建立了7种β-endamide药物在血浆中的残留检测方法,采用BEHC18(1.7m,100mm×2.1mm)柱分离试验,含有0.1%的水和乙炔作为流动相,所有药物在5.5min内检测完成,大大缩短了试验时间,所有药物回收率为86.8%~101.5%。Liu等人建立了检测牛奶中青霉素G、阿莫西林及多种代谢物(青霉素、青霉素脱唑、青霉素、阿莫西林、阿莫西林、地西泮)的方法,所有药物均采用ESI plus进行检测,8min内8种化合物成功分离,药物的定量限值为2.5~5.0 μg/kg,回收率为85.0%~108.0%, RSD低于13%。Tang等采用UPLC-MS/MS同时测定了牛奶中23种兽药的残留,包括7种β酰胺类药物、12种大环体和4种其他兽药,检测限均小于5 μg/mL,回收率分别为51.5%~100.6%、51.8%~139.0%和82.4%~102.5%, RSD分别小于15.0%。UpLC的使用大大提高了色谱分离,加快了药物分析速度,结合MS/MS检测仪可以提供详细的检测器分子质量和结构信息,使得UPLC-MS/MS在化学定性和定量检测中具有独特的优势,近年来在药物分析领域,食品检测应用发展迅速。
康德尼等人使用液相色谱-线性电离系列质谱法测定动物饲料中的药物残留物,如头孢菌素、头孢菌素、毒死蜱、二毒死蜱、青霉素G、青霉素V等。Dubala等人建立了一种LC-MS/MS方法,用于同时检测人血浆中的头孢子虫和克拉维克酸残留物,甲醇-乙炔-2mmol/L乙酸铵溶液(25:25:50,V/V,pH3.5))用于流动相,具有阴离子检测,分别选择m/z408(M-(CH3)-2H)和m/z198(M-H)-对于母体离子,SIM测试,2种药物的化学结构和全扫描见图5-41, Kantiani等人还研究了该方法的线性度,精度,准确性,离子抑制,基质效应,灵敏度和稳定性。
微生物学
微生物方法又称微生物抑制试验,是基于药物对微生物生理功能和代谢的抑制作用,定性或定量测定样品中的药物残留。常见的微生物方法有纸片法(paperdiskmethod,PD),三苯三苯三苯曲安奈德(TTC)法,圆柱扁法(CP),浊度法,Delvotest-SP法,微生物阻塞法等。
PD将阳性对照纸和装有待测牛奶样品的试纸放在接种菌株的琼脂平盘上,在合适的条件下培养,观察抗菌环以确定结果。TTC法是一种检测牛奶药物残留的定性方法,最早由Neel和Calbert等人于1955年提出,将牛奶中加入热成瘾链球菌作为培养菌株,根据TTC指标的颜色变化来判断结果。以旺大举等藤黄色八球菌为指标,以CP检测猪、鸡组织中氨苄西林残留物,最低检出限可达0.00025 μg/mL,比Vilim用热脂孢子测得的0.0009 sg/mL,标准曲线的工作范围为0.00125~0.02 μg/mL,变异系数为2.91±0.2%),不同浓度氨苄西林的回收率为83%~107%。李艳华等国标TTC法和AOAC纸法对牛奶中酰胺内药物残留的β检测结果,AOAC纸法能成功检测青霉素G、氨苄西林、羟嘧啶六种β内酰胺类药物的残留MRL浓度,而TTC法不能成功检测上述药物的MRL浓度,只能用于定性检测。微生物法易受其他抗生素在组织中的影响,特异性低,灵敏度低,但操作方便,样品剂量大,预处理简单,适用于大量样品筛选,常用于牧场、乳品企业等抗生素对牛奶样品进行大批量筛选检测。
公元7.2.5年
CE或HIGH毛细管电泳(HPCE)是一种液相分离技术,它使用高压电场作为驱动力,毛细管作为分离通道,根据样品组分之间电泳强度和分布行为的差异实现分离。与HPLC相比,HPCE具有色谱柱效率高、选择性好、样品量小、样品分析范围广等特点,是近年来分析化学中比较活跃的技术之一。由于β内酰胺类药物具有有机酸碱基团,因此在毛细血管区域活体游泳的方法也更为常见。采用HPCE-UV/DAD法检测环境污水和饲料中10 β种克拉维酸、阿莫西林、氨苄西林、青霉素G、青霉素V、吡哆醇、苯二氮卓类、毒死蜱、二氯硅素和吡拉西林,水样和饲料中的检出限分别为0.04~0.06 μg/L和0.80~1.4 μg/L,回收率为82.9%~98.2%,RSD小于9.0%。10种药物的色谱图如图5-42所示。Sérgio等人建立了同时检测牛奶氨、阿莫西林、青霉素、毒死蜱、四环素、氯霉素6种药物残留物、pH8.0 KH2PO4、Na2B4O7溶液中的CE,在18kV电压下,在210nm处检测到UVD,并在2.5 sg/mL2和5.0μg/mL的浓度下进行附加回收试验, 回收率超过72%,RSD低于5%。电渗流不稳定导致HPCE结果的再现性较差,HPCE的样品量小,灵敏度低于HPLC,在残留物分析中的应用受到限制。Bailon等HPCE-UV/DAD方法检测7种β端酰胺药物在水中的残留,可离线选择SPE纯化和浓缩样品,检测限为0.08~0.8μg/L,回收率为94%~99%,RSD小于10%。
7.2.6 免疫分析
该方法的优点是操作简单,检测速度快,一些生物样品如尿液可以直接测定,在β酰胺药物残留检测主要用于筛选和分析。免疫分析主要包括ELISA、放射免疫(RIA)等。ELISA是目前应用最广泛的免疫测定,拥有多种商业化的ELISA酶试剂盒,可用于检测多种兽药的残留,如Bioo USA生产的总抗生素(牛奶)试剂盒,可用于检测牛奶中的青霉素G、氨苄西林、阿莫西林、苯二氮卓类药物等β-赖氨酸药物残留, 测试限制在4.0微克/千克;组织中的青霉素G,限于0.2μg/ kg。Lamar等人使用用重组蛋白制备的青霉素结合蛋白(PBP)来建立ELISA以检测牛奶,牛肉,猪肉,蜂蜜,鸡蛋中的β酰胺残留物。
由于青霉素型药物分子中具有多个抗原决策簇,因此可以在动物免疫中产生多种类型的抗体,因此可以根据待测对象的结构和分析目的引导人工抗原的合成。为了获得主要鉴定青霉素药物的抗体,抗原决策簇需要以侧链抗原决策簇为主,因此在抗原合成中突出侧链结构,爱德华兹等成功的蛋白质载体交联到青霉素分子的环基上,得到特异性抗体。另外为了获得亲本特异性抗体,可以鉴定整个青霉素类药物,合成抗原以突出母体核结构(6-APA)。设拉子类等不同免疫抗原的合成方法,如透醛、青霉素反应,与小鼠免疫应答,得到多种青霉素交叉反应单克隆抗体,利用间接竞争ELISA可同时在牛奶和动物产品中氨苄西林、绿色霉素G、羟甲霉素、苯二氮卓类、二氯霉素等β端酰胺药物残留,检测限为2.5~5ng/mL, 并且检测灵敏度在欧盟MRL范围内。DeLewu等人直接利用6-APA制备抗青霉素蛋黄抗体,Diertihc等人利用双德海德的方法制备核特异性抗体,将氨苄西林侧链氨基与蛋白质连接起来,Cliuqet等利用青霉素生理反应合成青霉素蛋白,制备制得核特异性抗体。这些得到的母源特异性抗体与整个青霉素样药物具有很好的交叉反应,可用于青霉素样药物残留分析和检测。
张佳等人建立了对动物组织中β-cylamide型药物放射性受体残留物的快速筛选分析,成功用于青霉素G、阿莫西林、氨苄西林、二氯西林、毒死蜱、头孢菌素等药物残留物的检测,在90min内即可完成,大大加快了测定速度,节省了测定成本。Wei Dong等采用间接竞争性ELISA检测牛奶中阿莫西林残留,以合成AMX-OVA为检测抗原,以AMX标准品为竞争性半抗原,该方法的最小检测限为3.926 ng/mL,0.5~2000 ng/mL范围内样品添加的平均回收率为91.45%。