DNA纳米机器是基于DNA自组装的纳米结构。通过嵌入多种类型的功能核酸单元,DNA纳米机器可以响应肿瘤细胞中内源性刺激物(例如谷胱甘肽,microRNA等)引起的结构变化,以进行肿瘤细胞成像或治疗。然而,实体瘤的微观内向是复杂的,并且肿瘤细胞周围有大量的健康细胞(例如成纤维细胞,免疫细胞等)具有重要功能。传统的DNA纳米机器在进入靶向肿瘤细胞之前,由于实体瘤微环境中内源性刺激物的作用,经常被错误地激活,对周围的健康细胞造成毒副作用损害。因此,开发在细胞水平上特异性激活的纳米机器对于肿瘤的精确治疗具有重要意义。
细胞膜是将细胞与外部环境隔离的天然屏障,通过核酸拟合和膜蛋白结合,可以使DNA纳米机器在细胞膜表面的逻辑操作产生输出信号。在之前的研究中,生命分析化学国家重点实验室的朱启贤和刘颖教授报道了基于细胞膜上双受体的核酸拟合和结合的"双锁智能钥匙"DNA逻辑门模型,并实现了细胞亚型特异性区分(国家通讯2016,7,13580)。然而,在细胞膜表面完成"逻辑门"操作需要细胞膜上DNA链的迁移。这个过程依赖于DNA链的"脱落和重组",效率有限,容易出现假阳性结果。为了解决这个问题,该团队设计了一种纳米机器,用于跨细胞膜的DNA逻辑门操作(图1a),其两步DNA操作在细胞膜和细胞内进行,可以避免DNA纳米技术在实体瘤微环境中的非特异性活化,并实现生物体中实体瘤的精确光动力治疗。DNA纳米机器由上置纳米颗粒核心(UCNPs),DNA组装器L012和H012组成(图1b)。含有sgc8拟合的THEDNA链LA-apt与癌细胞膜上过表达的PTK-7蛋白结合,形成信号输入1;与DNA纳米复合器的L012部分一起,这两个信号输入形成"AND"逻辑门。
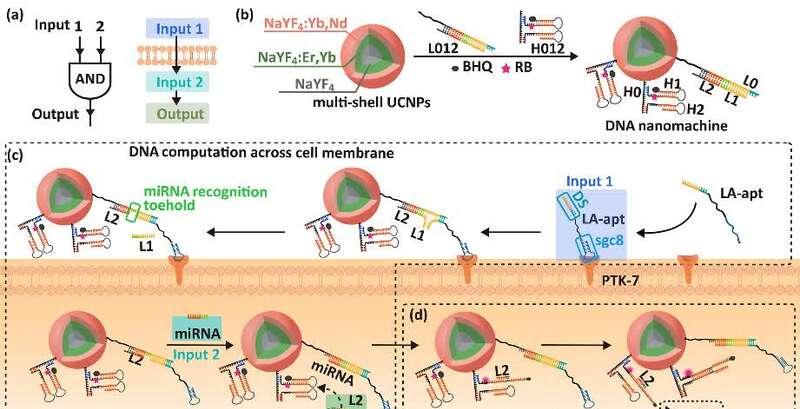
图 1.(a)DNA跨膜逻辑闸机操作和(b)DNA纳米机结构图。(c) L2通过LA-apt与PTK-7蛋白结合形成信号输入1和miRNA-21,用于信号输入2的跨膜操作而释放。(d) L2引发循环反应以恢复光敏活性。
DNA纳米机器的跨膜逻辑操作过程如下:LA-apt和L012在细胞膜表面杂交,替换L1链后暴露的miRNA-21的结合位点,诱导纳米颗粒进入细胞质;然后打开H2卡,为下一个周期重新释放L2链条。该过程不断恢复光敏剂的活性,产生由UCRPs的绿色发光光刺激的活性氧,使肿瘤细胞的光动力治疗成为可能(图1d)。
在DNA纳米机器上修饰ROS指标DHR123可验证细胞内的精确光动力疗法。在将LA-apt锚定在细胞表面后,由UCNPs-DNARB / BHQ孵育的MCF-7细胞在近红外光中产生显着的ROS(图2a),而对照组不能用ROS产生(图2b)。与miRNA-21阴性MCF-7细胞孵育后,未密封的对照材料URNPs-DNA'RB / BHQ和miRNA-21在细胞中显示出显着的ROS荧光;因此,封闭的miRNA鉴定位点确保光动力治疗仅在肿瘤细胞内发生,避免对正常细胞组织的损害,从而实现对癌细胞的准确和有效的光动力治疗(图2e)。
图 2.(a)处理MCF-7细胞后,THE-apt和(b)LA'-apt锚定URNPs-DNARB / BHQ的共聚焦成像。(c) 用UCPP-DNARB/BHQ或UCPP-DNA'RB/BHQ处理后LA-apt锚定miRNA-21阴性MCF-7细胞的共焦点成像。(d)MCF-7对照细胞和MCF-7细胞的细胞存活率不同。(e)MCF-7对照细胞,在UCPP-DNARB / BHQ(LA-apt-A),UCNPs-nrDNARB / BHQ(LA-apt-B)或UCPPs-DNA(LA处理后,LA-apt锚定MCF-7细胞,UCNPs-DNARB / BHQ处理(LA'-apt-A)后锚定细胞增殖速率。
光动力疗法对DNA纳米机器的影响也在动物水平上得到了验证(图3)。通过分别在UCPP表面和L0链末端标记Cy3和Cy5,得到双色纳米机UCPPSCy3-DNABHQ-Cy5,并在H1末端修饰的BHQ发出湮灭Cy3荧光。DNA纳米机器的激活通过Cy5荧光回收显示,通过Cy5在活体中DNA纳米机器的递送示踪剂。小鼠荧光成像表明,虽然纳米材料部分进入肝脏,但只有肿瘤具有明显的Cy3荧光,证明DNA纳米机器的跨膜操作仅在肿瘤细胞中被激活,不会对正常器官组织造成损害。
图 3.(a)注射LA-apt或LA'-apt的小鼠的活荧光成像和(b)器官和肿瘤组织成像,然后是UCNPsCy3-DNABHQ-Cy5或UCPNPsCy3-DNA'BHQ-Cy5小鼠。
上述结果于9月2日在《美国化学学会杂志》(DOI:10.1021/ jacs.1c06361)上在线发布。博士生张伟伟和陈伟伟是这项工作的合著者,朱玉贤教授和刘颖教授是合著者。
近年来,研究团队围绕上变频纳米技术在高效、准确诊断和治疗癌症方面的研发和性能,取得了一系列创新成果。发光增强的"能量集中域"结构旨在转换纳米材料(Angew.Chem. Int. Ed. 2019, 58, 12117-12122),开发了一种中继能量转移模式,以提高能量转移效率(CCS Chem. 2021, 3, 1510-1521),能够控制释放用于化疗药物的上转换发光驱动DNA偶氮苯纳米泵(Angew.Chem. Int. Ed. 2019, 58, 18207-18211)和近红外光响应microRNA放大器用于早期癌症精确光动力治疗(Angew.化学 Int. Ed. 2020, 59, 21454-21459),提出近红外光控撕裂对纳米胶囊siRNA的转化递送和基因治疗策略(Biomaterials 2018, 163, 55-66),通过近红外光瞬间点燃对纳米炸弹的转化,实现药物的快速释放和癌症的有效治疗(J. Control.版本2021,336,469-479)。
这些系列工作分别由国家自然科学基金(21890741)、重点项目(21635005)、人脸项目(21974064)、优秀青年基金(22022405)、青年基金(22004062)、江苏省自然科学基金优秀青年基金(BK20200010)、双创人才基金、生命分析化学国家重点实验室等单位资助。
来源:南京大学