目前,全球已有5款CAR-T産品經FDA準許上市,治療多種不同類型的血液系統惡性惡性良性腫瘤。CAR-T在血液惡性良性腫瘤領域一路高歌猛進,而在占比超90%以上的實體瘤領域,CAR-T療法則進展緩慢,困難重重。
針對CAR-T的實體瘤“困境”,本文總結了目前面臨的4大關鍵挑戰和近期最新的研究進展。
01
CAR-T的實體瘤“困境”
CAR-T進軍實體瘤主要面臨以下幾大挑戰:
1.1 缺乏有效靶點
與血液惡性良性腫瘤的靶點大多單一且具有特異性不同,實體瘤中惡性良性腫瘤特異性抗原(TSA)很少,目前發現的惡性良性腫瘤高表達的抗原多為惡性良性腫瘤相關抗原(TAA),在正常組織中也有表達。這就帶來了很高的脫靶風險,安全性成為關鍵問題。
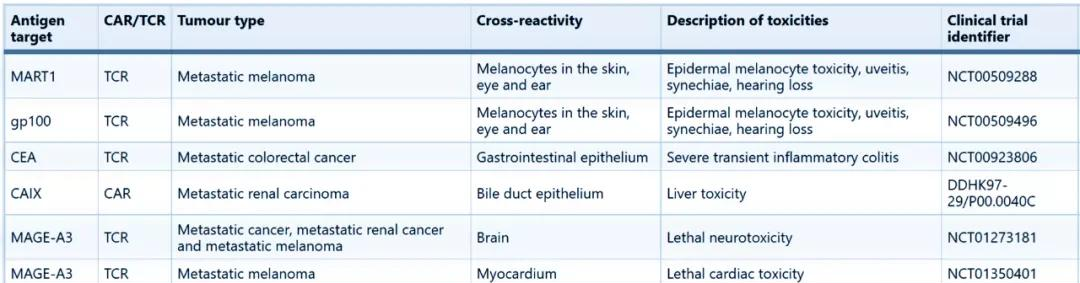
來源:Nature Reviews Drug Discovery
上圖為Nature Reviews Drug Discovery總結的近年來T細胞療法臨床試驗中因“on target, off-tumour” 産生的嚴重不良反應。同時,實體瘤存在高度異質性,即便有了安全的靶點,能否保證療效也是一個不小的挑戰。
1.2 CAR-T的轉運和浸潤
實體瘤具有幹擾T細胞轉運進行免疫逃逸的機制。一方面,與血液惡性良性腫瘤細胞呈分散狀不同,實體瘤往往形成堅實的團狀物,加上豐富的惡性良性腫瘤相關成纖維細胞(CAF)和血管,形成了一層天然的實體屏障。
另一方面,一些實體瘤會抑制某些趨化因子的分泌。趨化因子與其受體的互相作用會促進T細胞向惡性良性腫瘤微環境的遷移。同時,CAR-T細胞表面也缺乏與實體瘤分泌的趨化因子相比對的相關受體,造成CAR-T對惡性良性腫瘤部位的歸巢能力差。
1.3 惡性良性腫瘤微環境的免疫抑制
研究發現,惡性良性腫瘤微環境(TME)中低pH、低氧、高滲透,同時存在免疫抑制機制,極不利于T細胞的存活和發揮免疫效力。
限制CAR-T發揮抗惡性良性腫瘤作用的外部環境(來源:Nature Reviews Drug Discovery)
TME中存在免疫抑制細胞,如調節性T細胞(Treg)、骨髓源異質性細胞(MDSC)和M2型巨噬細胞。這些免疫抑制細胞在實體瘤内會釋放轉化生長因子β(TGFβ)和白細胞介素-10(IL-10)等細胞因子,降低回輸後CAR-T的抗惡性良性腫瘤效果。
1.4 内源性T細胞抑制信号
T細胞的免疫活性存在内源性調節機制,當T細胞過度活躍時,PD-1和CTLA4等分子發揮作用,維持免疫平衡。在CAR-T細胞被抗原激活後,PD-1和CTLA4與相關配體相結合,抑制T細胞的增殖和相關細胞因子的分泌。是以,内源性T細胞抑制信号也會降低CAR-T的抗惡性良性腫瘤活性。
02
CAR-T對抗實體瘤新政策
在對抗實體瘤的道路上CAR-T面臨多重困境,下面針對上述機制總結了目前CAR-T在實體瘤中的一些新突破。
CAR-T應對實體瘤的新政策(來源:Cancers)
2.1 提高CAR-T對抗原的識别
實體瘤中常見的TAA靶點包括CEA、HER2、GPC3、EpCAM等,TSA靶點較少,嚴重限制了CAR-T在實體瘤中的應用。除了繼續尋找和開發針對TSA靶點的CAR-T療法,還可以對CAR-T細胞進行改造,提高對惡性良性腫瘤抗原的識别能力。
4月28日,。WendellLim教授團隊在CAR-T細胞中植入了synNotch系統,在synNotch的調控下,識别相關TAA的CAR隻會在遷移到惡性良性腫瘤中的T細胞上表達,而不會攻擊正常組織中的細胞,大大提高了CAR-T識别抗原的特異性。(Science Translational Medicine, 2021, 13, 7378)
T細胞中的多抗原啟動和殺傷(prime-and-kill)回路提供了一種克服抗原異質性的通用政策,同時仍保持較高的惡性良性腫瘤特異性(來源:Science Translational Medicine)
近期,CAR-T療法教父Carl H. June團隊和Perelman醫學院的放射惡性良性腫瘤學教授Andy J. Minn團隊也發現了一種提高CAR-T對惡性良性腫瘤細胞識别的新方法—,給CAR-T配備了多種新“武器”,使得CAR-T不再“孤軍作戰”。多裝甲CAR-T可提高對惡性良性腫瘤細胞的浸潤和識别,且在抗原丢失的情況下,還能啟動内源性CAR-T來清除惡性良性腫瘤。(Cell,2021, 184, 19, 4981-4995)
“多裝甲”CAR-T可顯著提高抗癌效果(來源:Cell)
此外,除了對CAR-T細胞本身進行改造,科學家還利用外界條件提高CAR-T對惡性良性腫瘤細胞的特異性識别。8月12日,美國加州大學聖地亞哥分校的研究人員在 Nature Biomedical Engineering上發表了一篇研究進展,,可以在保護正常組織的同時摧毀惡性良性腫瘤組織,大大提高了CAR-T療法的安全性。(Nature Biomedical Engineering,doi.org/10.1038/s41551-021-00779-w)
2.2 多靶點聯用
目前針對兩個靶點的雙特異性CAR-T已在血液惡性良性腫瘤領域得到應用,可以提高CAR-T對抗原的識别能力,增加療效和安全性,降低惡性良性腫瘤逃逸的風險。靶向兩種或者多種不同TAA的 CAR-T療法也是治療實體瘤的重要方向。
9月23日,Nature Cancer上發表了一篇針對神經母細胞瘤(NB)模型的雙靶點CAR-T研究進展。該研究靶向GD2和B7-H3兩種NB相關抗原,并提供CD28和4-1BB共刺激,在小鼠中實作了快速和持續的抗惡性良性腫瘤作用,并能防止因抗原密度較低而産生的惡性良性腫瘤免疫逃逸。(Nature Cancer. 2021, 2, 904–918)
該實驗政策能防止因抗原丢失而産生的惡性良性腫瘤逃逸(來源:Nature Cancer)
2.3 改善T細胞的浸潤和轉運
治療血液惡性良性腫瘤時CAR-T通常采用靜脈回輸,在實體瘤中,為改善CAR-T的浸潤和轉運難題,可采用瘤内給藥的方式。瘤内給藥方式在胸膜惡性間皮瘤、頭頸癌和惡性膠質瘤的研究中都得到了較好的效果。
趨化因子是影響T細胞浸潤的重要分子,近年來針對趨化因子的研究給CAR-T攻克實體瘤帶來了新希望。9月22日,廣州百暨基因研發團隊首次将趨化因子受體CXCR5修飾到靶向EGFR的CAR-T細胞表面,用于治療非小細胞肺癌(NSCLC)。體内CAR-T示蹤實驗結果顯示,經過CXCR5修飾的CAR-T細胞可以定向遷移和滲透至惡性良性腫瘤病竈處,并顯著清除了惡性良性腫瘤,同時極大減輕了潛在的惡性良性腫瘤外毒性。(Molecular Therapy-Oncolytics , 2021, 22,507-517)
CAR-T細胞的體内抗惡性良性腫瘤活性(來源:Molecular Therapy-Oncolytics)
此外,也有一些研究靶向惡性良性腫瘤基質細胞中表達的成纖維細胞活化蛋白(FAP),可阻斷基質的形成,增強CAR-T對實體瘤的浸潤。
2.4 解除免疫抑制
TME産生免疫抑制作用的主要原因是免疫抑制細胞因子、免疫抑制細胞的存在和免疫激活因子的缺乏。TME中的免疫抑制作用是影響CAR-T在實體瘤中發揮效力的關鍵因素之一。
一些研究通過修飾CAR-T細胞,使其過度表達促進發炎的細胞因子(如IL-12、 IL-15和IL-18),這樣的CAR-T細胞被稱為“裝甲”CAR-T細胞(armoured CAR-T cells),可以調節局部微環境。研究證明,在卵巢癌中,IL-12可以提高T細胞的增殖和存活能力,抵抗凋亡和PD-1誘導的功能抑制。此外,對分泌IL-18的CAR T細胞的相關研究表明,這些細胞增殖和浸潤能力提高,并能募集内源性免疫細胞以調節TME。
降低TME中的免疫抑制(來源:American Journal of Cancer Research)
同時,由于TGFβ是一種重要的免疫抑制途徑,阻斷TGFβ信号也可提高CAR-T的抗惡性良性腫瘤效果。
除了TME中的免疫抑制作用,T細胞還存在内源性免疫抑制機制。目前,主要使用基因沉默、PD-1開關受體和與PD-1抑制劑聯用等手段來避免内源性抑制信号。
解除内源性T細胞抑制信号(來源:American Journal of Cancer Research)
03
聯用是未來方向
盡管CAR-T治療血液系統惡性惡性良性腫瘤後的緩解率很高,但達到持續緩解仍是不小的挑戰,患者往往會出現疾病複發的現象。CAR-T對抗惡性良性腫瘤的療效受到T細胞在體内的激活和擴增、殺傷效果和持久性等多種因素的影響,也與惡性良性腫瘤類型和患者個體差異息息相關。面對高度複雜的實體瘤,想要通過單一的CAR-T療法來平衡這些因素顯得舉步維艱。
除了強化CAR-T本身對惡性良性腫瘤細胞的殺傷作用,還應努力探索應對CAR-T擴增和持久性等難題的政策。CAR-T聯合傳統的放化療、免疫檢查點抑制劑、疫苗和溶瘤病毒等手段顯示出廣闊的應用前景,有望通過直接增強T細胞功能、招募内源性免疫細胞和重塑TME等途徑實作治療實體瘤的效果。
參考資料:
[1] Andrew J. Hou et al. Navigating CAR-T cells through thesolid-tumour microenvironment. Nature Reviews Drug Discovery. (2021)
[2] Yuna Jo. Innovative CAR-T Cell Therapy for Solid Tumor; CurrentDuel between CAR-T Spear and Tumor Shield. Cancers. (2021)
[3] 鄭彪點評 | Science突破:新型CAR-T有效殺傷實體瘤,不傷正常細胞(來源:醫藥魔方Pro)
[4] Koichi Hirabayashi et al. Dual-targeting CAR-T cells with optimalco-stimulation and metabolic fitness enhance antitumor activity and preventescape in solid tumors. Nature Cancer. (2021)
[5] Guangchao Li et al. CXCR5 guides migration and tumor eradication ofanti-EGFR chimeric antigen receptor T cells. Molecular Therapy-Oncolytics.(2021)
[6] Meijuan Huang et al. Innovative strategies to advance CAR T celltherapy for solid tumors. American Journal of Cancer Research.(2021)
[7] Joseph H. Choe et al. SynNotch-CAR T cells overcome challenges ofspecificity, heterogeneity, and persistence in treating glioblastoma. (2021)
[8] Lexus R. Johnson et al. The immunostimulatory RNA RN7SL1 enablesCAR-T cells to enhance autonomous and endogenous immune function. Cell (2021).
[9] Yiqian Wu et al. Control of the activity of CAR-T cells withintumours via focused ultrasound. Nature Biomedical Engineering. (2021)
[10] 姚铮等,CAR-T細胞免疫治療實體瘤的研究進展. 中國藥科大學學報(2021)
[11] 田永貴等,“下一代冶CAR T 細胞在實體瘤治療中的研究進展. 中國免疫學雜志(2020)