兩個月前,FDA 拒絕了 Intercept Pharmaceuticals(以下稱 Intercept)關于用奧貝膽酸(OCA)治療非酒精性脂肪肝炎(NASH)的申請,FDA 表示,當時的資料尚不能保證該藥對 NASH 相關肝纖維化患者的安全性和療效。近日,Intercept 稱将公布更多臨床資料用以支援此前的申請。
OCA 是目前唯一一個在治療 NASH 的關鍵 Ⅲ 期研究中達到終點的藥物,也是唯一一個獲得 FDA 突破性藥物資格認證的 NASH 藥物。如果此次資料得到 FDA 認可,對于 Intercept 而言意義重大。
NASH 全球患病率達到 25.24%,這是一種由肝髒中過多的脂肪堆積引起的進行性肝病,可引起慢性發炎,導緻進行性纖維化(瘢痕化),導緻肝硬化,最終肝衰竭,癌變和死亡。目前尚無 FDA 準許用于治療 NASH 的藥物。EvaluatePharma 預測全球 NASH 藥物的市場規模在 2025 年可以達到 400 億美元,可見其臨床需求之大。
2020 年 6 月 29 日,Intercept 公司宣布收到 FDA 拒絕 OCA 用于治療 NASH 所緻肝髒纖維化新藥申請的完整答複函(CRL)。CRL 指出,根據已審查的資料,FDA 認為 OCA 基于組織病理學試驗終點的預期益處尚不明确,而且治療收益并沒有超過潛在的風險,是以不支援加速準許 OCA 用于治療 NASH 導緻肝髒纖維化的患者。FDA 建議 Intercept 送出其它額外的中期資料并且進行長期研究。
Intercept 的補充資料将釋出在 2020 年國際數字肝髒大會上,該會将于 8 月 27 日線上上舉行,為期 2 天。該公司還将公布關于 PBC(原發性膽源性膽管炎)的資料。Intercept 總裁兼首席執行官 Mark Pruzanski 宣稱:新資料是對于 OCA 治療 NASH 所緻的晚期纖維化患者抗纖維功效的補充支援。另外,也将為大家呈現出 Ocaliva® 在治療 PBC 上的新進展,讓大家更深入了解 OCA 的長期安全性和有效性。
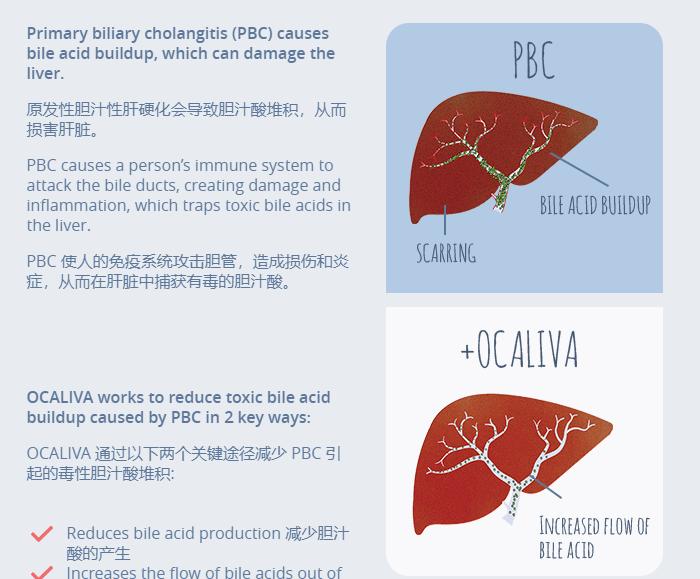
圖 | Ocaliva® 作用機理(來源:Ocaliva® 官網)
Intercept 公司創立于 2002 年,于 2012 年在納斯達克上市,是一家擁有 600 名員工的生物制藥公司,緻力于新型療法的開發和商業化,以治療進行性非病毒性肝病,包括 PBC 和 NASH。OCA 由 Intercept 公司研發,早在 2016 年 5 月,Intercept 公司就獲得 FDA 準許上市治療 PBC,同年 12 月,獲歐盟準許上市。是近 20 年來首個獲批治療 PBC 的藥物。
Intercept 作為首個宣布 NASH 新藥 OCA Ⅲ 期臨床試驗取得成功的公司,該藥物為公司的新藥開發提供了支援,也為 NASH 适應症的推廣積累了更加有力的資源。OCA 能否成功上市?NASH 患者能否迎來福音?我們将持續關注 Intercept 的資料是否讓 FDA“回心轉意”。當然,NASH 巨大的市場也吸引了衆多國内藥企,歌禮制藥、正大天晴、康德藥業等 10 多家企業都在布局這一領域。