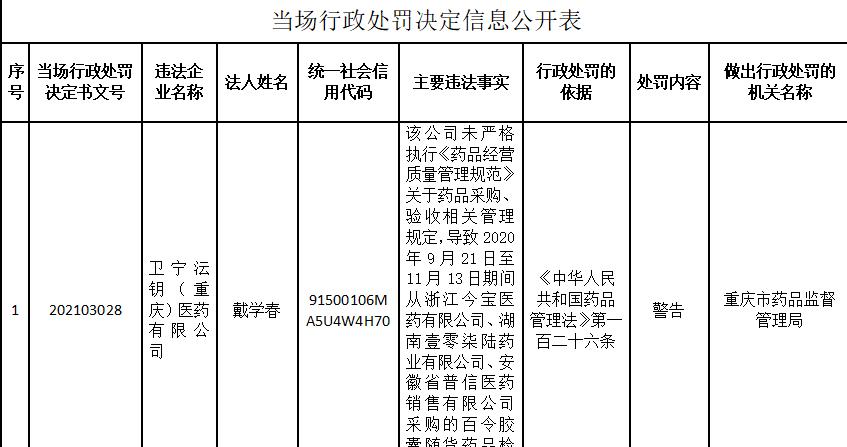
中國經濟網北京12月15日訊 重慶市藥品監督管理局網站日前公布的當場行政處罰決定資訊公開表顯示,衛甯沄鑰(重慶)醫藥有限公司未嚴格執行《藥品經營品質管理規範》關于藥品采購、驗收相關管理規定,導緻2020年9月21日至11月13日期間從浙江今寶醫藥有限公司、湖南壹零柒陸藥業有限公司、安徽省普信醫藥銷售有限公司采購的百令膠囊随貨藥品檢驗報告涉嫌系僞造。重慶市藥品監督管理局依據《中華人民共和國藥品管理法》第一百二十六條規定,對其警告。
經中國經濟網記者查詢發現,衛甯沄鑰(重慶)醫藥有限公司為上海帝林生物科技開發有限責任公司全資子公司,上海帝林生物科技開發有限責任公司為衛甯沄鑰科技(上海)有限公司全資子公司,衛甯沄鑰科技(上海)有限公司第一大股東為衛甯健康(“衛甯健康”,300253.SZ),持股比例45.70%。
衛甯沄鑰科技(上海)有限公司原名“上海鑰世圈雲健康科技發展有限公司”,已于2021年7月更名,衛甯健康年報顯示,鑰世圈公司為非同一控制下企業合并,作為公司雲藥平台,積極推動處方流轉平台的搭建、布局和營運,持續優化電子處方安全管理與流轉平台的開發與試點。同時,與相關醫藥及健康産品主流分銷商、零售商實作了系統對接、品種比對和庫存同步,緻力打造“開放、中國聯合網絡通信、共赢、中立”的院外藥品及健康産品供應鍊。鑰世圈納入公司合并報表範圍後,公司将加強對鑰世圈的戰略扶持,加大體系内各類資源的投入、嫁接和協同發展,進一步促進衛甯雲藥戰略的落地和快速擴張。
《中華人民共和國藥品管理法》第一百二十六條規定:除本法另有規定的情形外,藥品上市許可持有人、藥品生産企業、藥品經營企業、藥物非臨床安全性評價研究機構、藥物臨床試驗機構等未遵守藥品生産品質管理規範、藥品經營品質管理規範、藥物非臨床研究品質管理規範、藥物臨床試驗品質管理規範等的,責令限期改正,給予警告;逾期不改正的,處十萬元以上五十萬元以下的罰款;情節嚴重的,處五十萬元以上二百萬元以下的罰款,責令停産停業整頓直至吊銷藥品準許證明檔案、藥品生産許可證、藥品經營許可證等,藥物非臨床安全性評價研究機構、藥物臨床試驗機構等五年内不得開展藥物非臨床安全性評價研究、藥物臨床試驗,對法定代表人、主要負責人、直接負責的主管人員和其他責任人員,沒收違法行為發生期間自本機關所獲收入,并處所獲收入百分之十以上百分之五十以下的罰款,十年直至終身禁止從事藥品生産經營等活動。
以下為原文: