雲栖号資訊:【 點選檢視更多行業資訊】
在這裡您可以找到不同行業的第一手的上雲資訊,還在等什麼,快來!
新冠病毒确實新,但又不能算全新。目前正在世界範圍内肆虐的這波病毒與2002至2003年引發嚴重急性呼吸系統綜合症(SARS)的病毒非常相似,是以病毒學家們初步将其簡稱為SARS-CoV-2。
但相距17年,兩波病毒之間也存在着一系列核心差異。好消息是,雖然新冠病毒的感染能力更強,但緻命程度似乎不及早期SARS病毒。SARS-CoV-1曾感染約8000人,而緻死率達到約七分之一。而目前SARS-CoV-2病毒的已知緻死率(雖然仍未最終确定)要低得多,可能比七十分之一還更低些。
不過壞消息是,SARS-CoV-2的傳播範圍比當初的SARS-CoV-1更廣泛,部分原因在于不少感染者的早期症狀較為溫和、而且新冠病毒的潛伏期也更長。總而言之,與SARS相比,新冠病毒的感染者很可能在不經意間把體内的病毒傳播給他人。
為了深入了解造成這種差異的原因,研究人員們正在深入剖析新冠病毒蛋白質的三維結構,特别是其中負責感染人類細胞并進行自我增殖的部分。由此帶來的見解,有望為測試當中的治療方法與疫苗研發提供重要線索。
醒目的刺突結構
如今,人們對于新冠病毒的認識正在快速提升。截至目前,最受關注的是其中存在的刺突蛋白:一種在電子顯微鏡下呈現出刺突形狀的蛋白。帶有這類蛋白質的病毒會具備特殊的冠狀結構,這也是冠狀病毒名稱的由來。
是以,科學家們也将注意力集中在這些刺突身上,因為他們意識到這些結構在感染中扮演着至關重要的角色。刺突不僅維持着病毒的自身性狀,同時也成為識别、結合并進入宿主細胞的結構性前提。
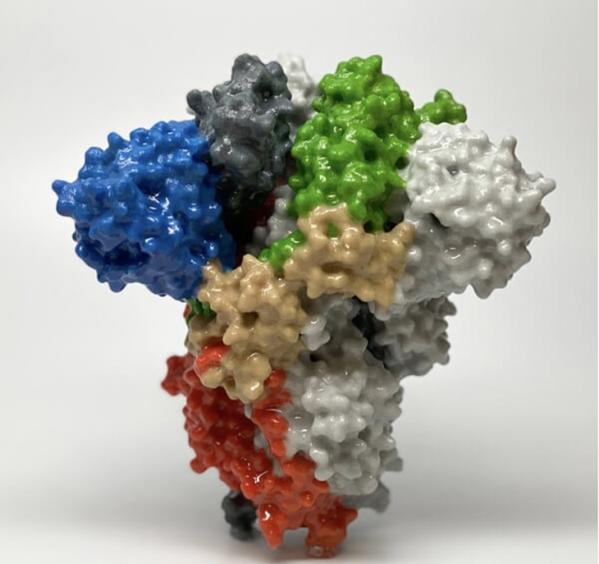
刺突蛋白的3D列印模型
該病毒的首條遺傳序列于1月11日正式公布給全球研究人員。不到六周之後(今年2月19日),得克薩斯大學奧斯汀分校的結構生物學家Jason McLellan帶領的實驗室研究小組就在《科學》雜志上發表論文,提示了SARS-CoV-2病毒中刺突蛋白的三維結構。McLellan實驗室的一位研究人員晝夜不停地推導這種結構,他表示“結構本身看起來像蘑菇,擁有明确的頭部與莖部區分。”
刺突的頭部(也被稱為S1)為首先附着至宿主細胞上的部分。具體來看,它會與ACE2受體相結合,而該受體位于人體内某些組織細胞的外表面上,包括肺部之内的各類組織。ACE2的正常功能當然不是幫助病毒完成滲透,而是用于實作對器官的血壓調節。然而,SARS-CoV-2與十幾年前曾經爆發的近親SARS-CoV-1都選擇了ACE2作為突破口。
在這兩種病毒中,S1尖頭均使用一串被稱為受體結構基序的氨基酸來識别ACE2受體并完成鎖定與滲透。Wang解釋道,有趣的是,SARS-CoV-1與SARS-CoV-2所使用的實際基序結構卻有所不同。總體來看,構成這兩種病毒刺突蛋白的氨基酸序列中約有80%相同,但受體結合基序則隻有約50%的共性。
由于在識别ACE2受體方面發揮着關鍵作用,這部分結合基序的序列與結構很可能對刺突蛋白與受體間結合的可能性産生重大影響——研究人員将此稱為結合親和力。在同一期《科學》雜志上報告的另一項實驗表明,SARS-CoV-2刺突蛋白與ACE2的結合親和力,要比SARS-CoV-1刺突蛋白高10至20倍。Wang表示,這也許能夠解釋為什麼SARS-CoV-2在人與人之間的感染能力方面要遠遠高于SARS-CoV-1。“但是,我們還需要更多強有力的證據以證明這一點。”
廣州華南農業大學病毒學家Ding Xiang Liu指出,由于ACE2受體的具體結構取決于具體物種,是以該病毒必須進行大量變異才能獲得人體感染能力。這位病毒學家曾在《年度微生物學評論》中概述人類冠狀病毒與宿主之間的互相作用機理。
很明顯,存在衆多不同物種的動物交易市場是病毒進行變異測試的理想環境。Liu指出,“是以,我們應該管控此類交易活動,特别是食用野生動物。”
強制融合
在刺突蛋白附着于ACE2受體之後,科學家們認為人體細胞周圍的膜可能會吞噬病毒,将其引入内部并運輸至溶酶體。所謂溶酶體是一種含酶的泡體,其作為進化防禦機制的組成部分将潛在入侵者的蛋白質切割成安全無害的小片段。
但是,SARS-CoV-1與SARS-CoV-2等病毒的刺突蛋白開始做出有針對性的進化,希望利用這種自我防禦機制入侵細胞。實際上,二者的蛋白質隻有在被一種或者多種細胞内的酶切割之後,才能執行下一步行動:将病毒與溶酶體周圍的膜拉近、直至融合。如此一來,病毒中的遺傳物質就能從溶酶體散逸至細胞當中。
美國患者的分離株,導緻該疾病的病毒SARS-CoV-2的顆粒呈藍色
這些病毒的遺傳物質為RNA,而非DNA。RNA與人體細胞當中用于将遺傳指令由細胞核傳遞至蛋白質建構位置的分子相同。是以,當病毒RNA被從溶酶體釋放出來時,細胞即會迅速發揮作用,建構其指定的蛋白質結構,進而使病毒得以繁殖與擴增。
Liu解釋道,危險也正源于此。盡管我們通常将免疫系統視為保護人體的重要載體,但在某些患者體内,大量産生的病毒RNA與蛋白質會導緻免疫系統開始趣事運轉,最終導緻嚴重的疾病甚至死亡。Liu指出,這種“過度旺盛”的免疫反應正是“引發組織損傷與器官衰竭的主要原因”,不少COVID-19患者也是是以而失去了生命。
疫苗病毒研發
目前,已經有多項試驗正在測試用于治療其他疾病(包括某些病毒感染)的現有藥物,希望從中發現能夠抑制SARS-CoV-2病毒的選項(例如幹擾新冠病毒的自我複制過程)。但也有不少科學家認為,最靠譜的方法是開發一種新型疫苗,幫助我們的免疫系統更好地抵禦SARS-CoV-2引發的初步感染。
各團隊正在努力開發這種疫苗,其中可能包含已死亡或者經過毒性弱化處理的病毒,也可能存在病毒蛋白中的某些特定片段,外加能夠刺激免疫系統做出正常反應的其他幾種物質。人體将針對疫苗内容物産生阻斷分子結合的抗體,進而将類似物質标記為病毒并指派白細胞将其破壞。
但除了以上傳統思路,疫苗也擁有其他破壞SARS-CoV-2蛋白結構的途徑。例如,附着在刺突蛋白受體結合基序上的抗體也許可以阻止該蛋白與ACE2受體相結合,進而阻止病毒感染人體細胞。與刺突蛋白其他部位結合的抗體則能夠阻止病毒與細胞膜融合起來,進而防止病毒的遺傳物質被融入細胞的蛋白質構成流程。當然,僅僅獲得刺突蛋白的結合抗體還遠遠不夠;某些抗體并不會影響蛋白質的實際功能,另一些抗體甚至反而會增強目标蛋白的功能。
Wang解釋道,批量生産這類包含足夠數量蛋白質(例如SARS-CoV-2刺突蛋白)的疫苗往往非常困難且成本高昂。“蛋白質很難制造,而且不容易長期保持其品質。”為此,某些企業可能會受到病毒本身的啟發,采用另一種解決思路。他們選擇包含蛋白質建構說明的RNA,而非直接使用蛋白質。一旦人體細胞建構起這種蛋白質,免疫系統就能夠産生對應的抗體。科學家們目前正在測試這種包含RNA的疫苗,其中RNA的作用就是提供SARS-CoV-2刺突蛋白的遺傳編碼。
Wang希望關于刺突蛋白結構的認識能夠帶來更具針對性的治療方法。通過制造新疫苗,研究人員希望能夠引入一部分已經與抗體結合的刺突蛋白,或者允許人體細胞自行建構這部分RNA指令,進而完成對病毒的阻斷。
抗體來源
目前,全球已經有約35家企業及學術機構在着手研究疫苗。但這仍然需要時間,而且疫苗對于已經感染的群體起不到任何作用。
是以,除了嘗試現有療法之外,一部分研究人員還試圖在實驗室中制備針對刺突蛋白的抗體,并以藥物形式将其注入人體。整個研究過程可以通過多種方式來完成,例如将病毒刺突蛋白注射進經過基因修飾以産生類人抗體的小鼠當中,而後通過測試檢驗其産生的抗體能否有效阻斷病毒傳播。
在3月12日發表的一篇非經同行審議的論文中,分子生物學家Frank Grosveld與病毒學家Berend-Jan Bosch上司的荷蘭研究小組宣布,這種方法建立出的一種抗體(他們總計創造出51種抗體)似乎非常有效。研究小組的實驗結果表明,這種名為47D11的抗體能夠與SARS-CoV-1及SARS-CoV-2的刺突蛋白相結合,進而阻止現有及其他帶有SARS-CoV系刺突蛋白的病毒感染正常細胞。(目前尚不清楚該抗體的确切起效方式。單從觀察出發,雖然它能夠與刺突蛋白的受體結合部分連接配接,但似乎并沒有實際阻止刺突蛋白與ACE2受體相結合。)
目前該小組正在對抗體進行測試,希望了解它能否幫助小鼠及其他動物免受感染。如果實驗獲得成功,接下來就是在臨床實驗中證明其安全性與有效性。更重要的是,這項研究也有望帶來其他更加高效的病毒測試方法。
Wang表示,“目前我們還無法斷言能否将抗體作為行之有效的治療手段。但很明顯,這是個前景光明的發展方向。”
最終,這些發明有望帶來一種全新疫苗,其中可能包含一部分已經與47D11抗體相結合的蛋白質,或者是與之對應的蛋白質合成指令。Wang指出,直接向人體内注射治療性抗體的方法往往存在周期性限制,意味着我們需要定期補充才能維持治療效果。與之對應,良好的疫苗能夠指導人體在需要時自主制造抗體,進而實作一次注射、終身免疫的最佳防治目标。
【雲栖号線上課堂】每天都有産品技術專家分享!
課程位址:
https://yqh.aliyun.com/zhibo立即加入社群,與專家面對面,及時了解課程最新動态!
【雲栖号線上課堂 社群】
https://c.tb.cn/F3.Z8gvnK
原文釋出時間:2020-03-25
本文來自:“
科技行者”,了解相關資訊可以關注“
”